Robert L. Unckless, Andrew G. Clark and Philipp W. Messer. Evolution of Resistance Against CRISPR/Cas9 Gene Drive. Genetics Early online December 10, 2016; https://doi.org/10.1534/genetics.116.197285;
Charleston Noble, Jason Olejarz, Kevin Esvelt, George Church, Martin Nowak. Evolutionary dynamics of CRISPR gene drives. doi: https://doi.org/10.1101/057281;
James J. Bull. Lethal gene drive selects inbreeding. Evol Med Public Health (2017) 2017 (1): 1-16. DOI: https://doi.org/10.1093/emph/eow030
 © Лазебный Олег Евгеньевич
- старший научный сотрудник лаборатории эволюционной генетики развития ИБР РАН, кандидат биологических наук. Область научных интересов: генетика поведения, генетика количественных признаков, популяционная и эволюционная генетика.
© Лазебный Олег Евгеньевич
- старший научный сотрудник лаборатории эволюционной генетики развития ИБР РАН, кандидат биологических наук. Область научных интересов: генетика поведения, генетика количественных признаков, популяционная и эволюционная генетика.
Еще до возникновения генетической инженерии с арсеналом методов создания рекомбинантной ДНК ученые мечтали о таком манипулировании наследственностью, которое позволяло бы с высокой степенью надежности и эффективности закреплять определенные генетические свойства в популяциях животных и растений. Мы являемся свидетелями создания такой мощной и многообещающей технологии, которая называется генный драйв CRISPR/Cas9 (рис. 1, 2, 3). Генный драйв CRISPR/Cas9 является частным случаем генетического драйва, проявляющегося в неслучайном увеличении частоты определенных генетических последовательностей, не связанном напрямую с естественным отбором, а обеспечиваемом специфическими молекулярными механизмами – драйверами (рис. 1).
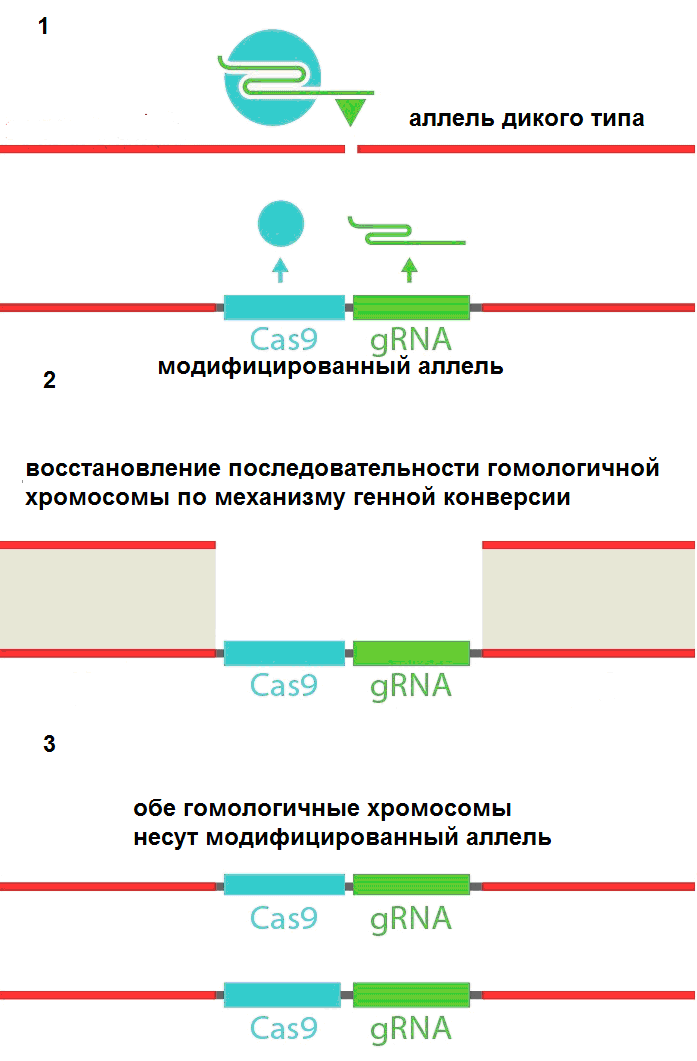
Рисунок 1. Схема генного драйва на примере системы CRISPR/Cas9. 1. После внедрения генного драйва CRISPR/Cas9 в ген-мишень на одной из гомологичных хромосом с образованием модифицированного аллеля гена-мишени, генный драйв начинает работать с образованием направляющей РНК (gRNA) и эффекторного белка Cas9. Образующийся РНК-белковый комплекс вносит разрыв в двойную цепь ДНК гомологичной хромосомы в строго определенном месте. 2. Восстановление повреждения на гомологичной хромосоме по механизму генной конверсии с использованием матрицы генного драйва. 3. В результате восстановления структуры ДНК гомологичной хромосомы генотип диплоидной особи из гетерозиготного (аллель дикого типа и модифицированный аллель) становится гомозиготным по генетически модифицированному аллелю.
Важным следствием данного процесса является неконтролируемый или слабо контролируемый рост численности мобильных генетических элементов в геноме особи либо популяции какого-либо вида (Рис. 2). Похоже, она повторяет историю создания и мгновенного распространения ПЦР – технологии, перевернувшей в конце прошлого века молекулярную генетику в частности и биологию в целом. Необходимо отметить, что метод генного драйва позволяет быстро распространять в популяции даже аллели с отрицательным эффектом на приспособленность.
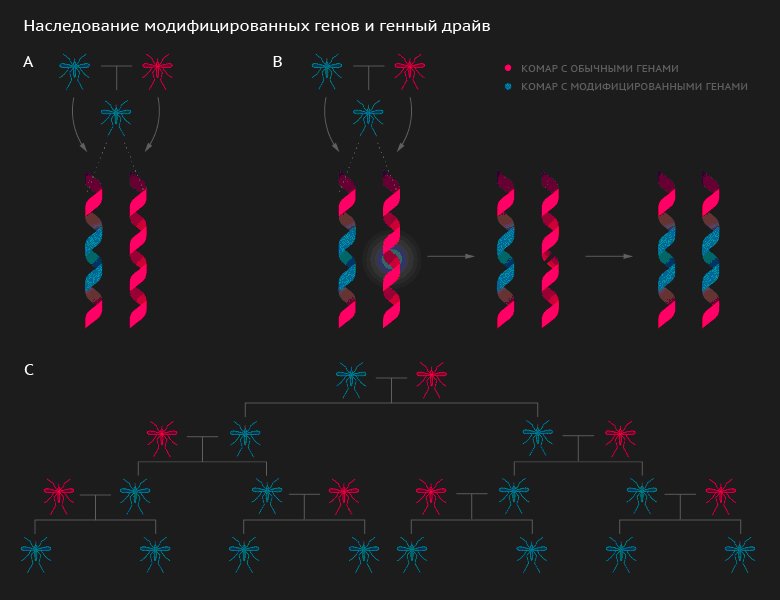
Рисунок 2. А – метод обычной модификации генов, при котором модифицированный аллель все время находится только в гетерозиготном состоянии, так как наследуется только половиной потомства. Если такого гетерозиготного комара выпустить в природу, где этот комар и его потомство будет преимущественно скрещиваться с особями дикого типа, то модифицированный аллель постепенно «растворится» в природной популяции. В – метод генного драйва: схема молекулярного механизма. Ген-модифицированный комар при скрещивании с особью дикого типа передает по наследству одну хромосому, несущую модифицированный аллель гена-мишени. В прогенеративных клетках гетерозиготного потомства система CRISPR/Cas9 активируется и модифицирует ген-мишень по своему образу. В результате, все потомство становится гомозиготным по модифицированному аллелю. С – метод генного драйва: схема наследования. Теоретически достаточно выпустить в природу одного ген-модифицированного самца с системой генного драйва (CRISPR/Cas9). Все скрещивания этого комара с самками дикого типа будут приводить к появлению потомства, гомозиготного по модифицированному аллелю гена-мишени. Соответственно, в скрещиваниях потомства единственного ген-модифицированного комара с особями дикого типа будет получаться в свою очередь гомозиготное по модифицированному аллелю потомство. Таким образом, частота модифицированного аллеля будет лавинообразно нарастать в природной популяции комара.
Повторим кратко историю создания новой революционной технологии.
1987 год – последовательности CRISPR найдены группой японских ученых у E. coli. Этому открытию не придали большого значения.
2000 год – испанским ученым Франсиско Мохика установлена общность CRISPR-массивов у многих микроорганизмов.
2002 год – открытие генов cas, являющихся составной частью CRISPR-локуса и кодирующих белки Cas.
2007 год – установлено, что CRISPR-повторы являются частью бактериальной защиты от вирусов. Потребовалось ровно 20 лет, чтобы установить функцию генетических элементов, открытых японскими учеными.
2012 год – первое использование CRISPR-повторов для геномного редактирования. Осознание глобального характера метода и его огромных потенциальных возможностей.
2013 год – система CRISPR-редактирования апробирована на клетках мыши и человека, поданы заявки на патенты, увлечение методом принимает лавинообразный характер.
2014 год – получен патент на CRISPR-редактирование генов. Начало бурной реакции общественности.
2015 год – сообщение о первом CRISPR-опосредованном генном драйве – мечта поколений ученых-генетиков стала реальностью. От возможностей созданной руками человека технологии захватывает дух: реальным становится полное уничтожение возбудителей таких заболеваний, как малярия, причем в кратчайшие сроки, жесткий контроль вредных насекомых и паразитов, сохранение видов, находящихся на грани вымирания, лечение наследственных и онкологических заболеваний у человека. Последняя возможность вызвала острейшие неутихающие дебаты по всей планете, поскольку в этом же году метод CRISPR-редактирования был применен на человеческих эмбрионах.
Как видно из краткого исторического экскурса, развитие технологии CRISPR/Cas9 геномного редактирования вызвало неоднозначную реакцию, по крайней мере, в среде научной общественности. Страсти накалились настолько, что в декабре прошлого года под эгидой ООН состоялась 13-ая Конференция по биоразнообразию, на которой должны были рассмотреть вопрос о введении моратория на использование технологии генного драйва. К счастью для нас, идеологам и практикам генного драйва удалось отстоять возможность применения технологии в условиях лаборатории. Однако о проведении широкомасштабных полевых испытаний в ближайшие годы не может быть и речи. В том числе, невозможно проведение подготовленной учеными акции такой, как тотальное уничтожение малярийного плазмодия, от которого ежегодно погибает до полумиллиона человек.
Как же можно в таких условиях оценить последствия масштабного применения генного драйва? Сподвижники сверхновой технологии не растерялись и уже начато теоретическое моделирование последствий такого применения. Три коллектива авторов проводят независимые теоретические разработки по возможностям контроля генного драйва с помощью аллелей устойчивости. Обнадеживающий общий вывод таков: «Практически неизбежно устойчивость будет развиваться в стандартных системах генного драйва». Во-первых, во время конверсионного восстановления последовательности хромосомы, в которую вносится генный драйв, может происходить негомологичное соединение концов, препятствующее переносу генного драйва и приводящее к возникновению аллеля резистентности. Во-вторых, более двух-трех замен в сайте узнавания Cas9, а также любые замены в PAM-последовательности или любые вставки/делеции в области генного драйва могут приводить к образованию аллеля резистентности.
Первая группа исследователей под руководством Филиппа Мессера обнаружила, что возникновение резистентности в большой степени зависит от частоты негомологичного соединения концов и размера популяции. Вторая группа исследователей, Чарльзстон Нобль с коллегами, пришли к аналогичному выводу, однако они пошли дальше и показали, что многоцелевой генный драйв способен обойти резистентность, если встроится хотя бы в один из целевых локусов. Также возникновение резистентности будет весьма затруднено, если «задрайвить» жизненно важный ген: организм без него не выживет. Третья команда из Техасского университета в Остине под руководством Джеймса Булла пошла совершенно другим путем: они рассмотрели возможность появления резистентности через поведение, например, особи целевой популяции перестают скрещиваться с генетически модифицированными особями. Авторы обнаружили, что в инбредной популяции генный драйв распространяется заметно хуже, чем в аутбредной.
В заключении хотел бы поделиться двумя соображениями. Первое. Всегда найдутся скептики, которые будут утверждать, что математические модели можно подогнать подо что угодно. Но как еще можно двигаться вперед в столь ограниченных условиях?! Модели будут развивать и усложнять, приводя их в большее соответствие с реальностью. Второе. Да, человечество создало не только мирный атом, но и атомную бомбу. Кстати, физики могут уничтожить биосферу похлеще нас, генетиков. Но это разве причина не развивать атомную энергетику?! А какое же покорение дальнего космоса без ядерных силовых установок? Распространение генетически модифицированных организмов поначалу тоже панику вызвало. До сих пор дебаты идут. Однако сейчас уже невозможно представить, как иначе решить продовольственную проблему. Уверен, так же будет и с технологией генного драйва, технологией будущего.
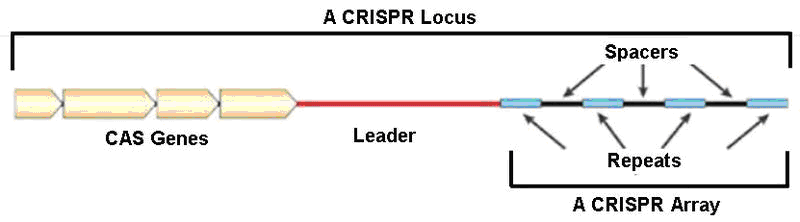
Рисунок 3. CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats – сгруппированные регулярно перемежающиеся короткие палиндромные повторы) – блоки прямых палиндромных, т.е. взаимокомплементарных последовательностей, способных складываться в шпильки, повторов ДНК размером 24–48 пар нуклеотидов (рис. 1). Эти повторы перемежаются спейсерами – уникальными последовательностями примерно такой же длины. Спейсеры заимствуются из чужеродных генетических элементов (бактериофагов, плазмид), с которыми сталкивалась клетка или ее предки. Повторы со спейсерами, число которых варьирует от единиц до сотен, входят в состав специфических локусов бактерий и архей. Перед массивом CRISPR-элементов расположена лидерная последовательность (Leader), богатая «легкоплавкими» АТ-парами и содержащая промотор, который контролирует транскрипцию CRISPR-массива. Важной частью локуса является также кластер генов cas, продукты которых способствут встраиванию спейсеров и уничтожению агентов с идентичными последовательностями (протоспейсерами). Функцию уничтожения выполняют Cas-белки, называемые эффекторными. В зависимости от типа эффекторов все CRISPR-системы разделяют на два класса: у класса I мишень уничтожается мультибелковым комплексом, а у II – одним крупным белком. Далее эти классы подразделяются на шесть типов. Большинство эффекторов атакует ДНК, лишь один – исключительно РНК, редкие – обе молекулы. Один организм может содержать несколько разных систем, а спейсеры различаются в разных клетках даже одной популяции. Для решения генно-инженерных задач больше всего подходит система II типа, относящаяся ко II классу, – она самая простая. Именно ее эффекторный белок называется Cas9 – то самое обозначение, что фигурирует в современных системах редактирования генома.
Новость подготовил © 2017 Лазебный О.Е.
10.04.2017