 © Мельникова Виктория Ильинична,
кандидат биологических наук, старший научный сотрудник.
© Мельникова Виктория Ильинична,
кандидат биологических наук, старший научный сотрудник.
Область научных интересов: нейроэндокрино-иммунные взаимодействия в онтогенезе, нейробиология развития, участие нейротрансмиттеров в регуляции развития периферических органов.
Авторы работы рассказывают о первых достижениях в реализации нового масштабного исследования пренатального развития иммунной системы человека. Ведущие коллективы британских исследователей объединили усилия для реализации новой инициативы "Атлас клеток человека". Такие исследования стали возможны благодаря высокому уровню развития современных Single-cell мультиомных технологий (включающих геномный, транскриптомный, протеомный анализы, а также современные технологии визуализации на уровне единичной клетки). И хотя этот проект еще далек от завершения, получаемые результаты обеспечивают беспрецедентное развитие представлений о формировании иммунной системы человека в раннем онтогенезе.
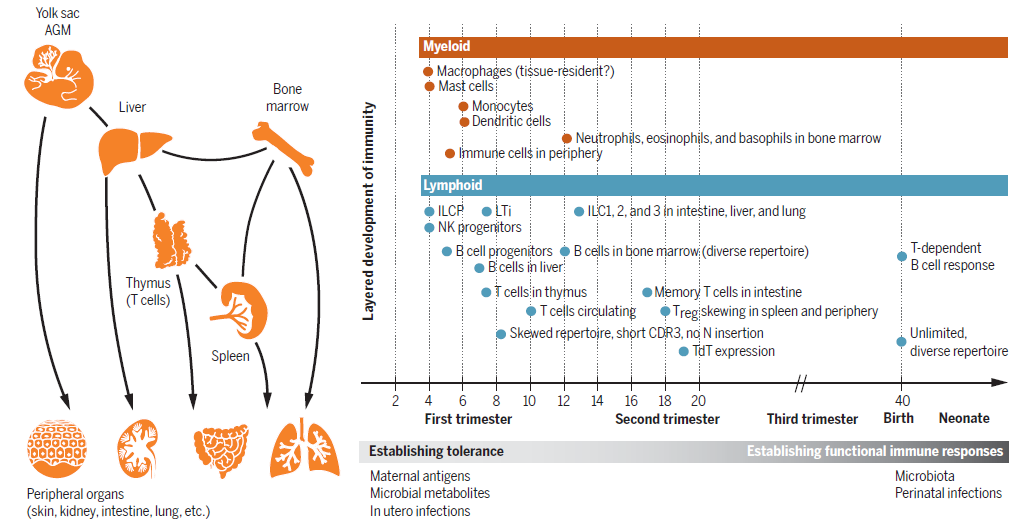
Рис. 1. Пространственно-временные характеристики развития иммунной системы человека.
Развитие гемопоэза и иммунной системы в раннем эмбриогенезе человека происходит в нескольких анатомических сайтах. Основной сайт кроветворения смещается в эмбриогенезе из желточного мешка и аорто-гонадо-мезонефроса к эмбриональной печени и костному мозгу. Дифференцировка и созревание Т-клеток ограничены тимусом. Клетки иммунной системы в дальнейшем мигрируют в другие периферические органы, включая лимфатические узлы, кожу, кишечник, почки и легкие, и адаптируются к среде соответствующего органа. Разные типы клеток иммунной системы дифференцируются на разных стадиях беременности, что необходимо для формирования толерантности и функциональной реакции в соответствии с потребностями развития. Это позволяет подготовить развивающийся эмбрион и плод к встрече с антигеном в пре- и постнатальном развитии.
Предыдущие исследования модельных экспериментальных животных обеспечили нам фундаментальные представления о развитии гемопоэза и иммунной системы. Тем не менее, хронология эмбрионального развития человека значительно отличается от таковой у других видов млекопитающих. Например, эмбриональный тимус у мышей и крыс гораздо менее зрелый, чем у человека, где он поддерживает полноценную дифференцировку наивных Т-лимфоцитов еще до рождения. Некоторые маркеры клеточных популяций не отличаются филогенетической консервативностью, что затрудняет приложение полученных на животных знаний к человеку. Также известно, что микробиом матери оказывает значимое влияние на развитие иммунной системы плода, а репертуар симбиотной и патогенной флоры также различен у животных и человека.
От одиночных клеток к развитию на системном уровне
Современные методы single-cell секвенирования РНК (scRNA-seq) масштабированы до такой степени, что позволяют проводить анализ клеток целого органа, например, желточного мешка или эмбриональной печени, для реконструкции ранних этапов гемопоэза. Развитие вычислительных мощностей позволило решать задачу сравнения состояний клеток в разных тканях и прогнозирования критических лиганд-рецепторных взаимодействий, которые способны определять судьбу клеток иммунной системы в зависимости от локализации. Комбинирование других подходов с методами визуализации, такими, как in situ транскриптомика, сделало возможным получить исчерпывающие характеристики тканевого микроокружения. Современные возможности позволяют отслеживать траектории развития отдельных клеток в пределах органа. Между тем, остается немало нерешенных проблем, связанные с отслеживанием происхождения конкретных клеток системы и изучением волн гемопоэза. Комплекс современных подходов положил начало всестороннего изучения раннего развития системы иммунитета
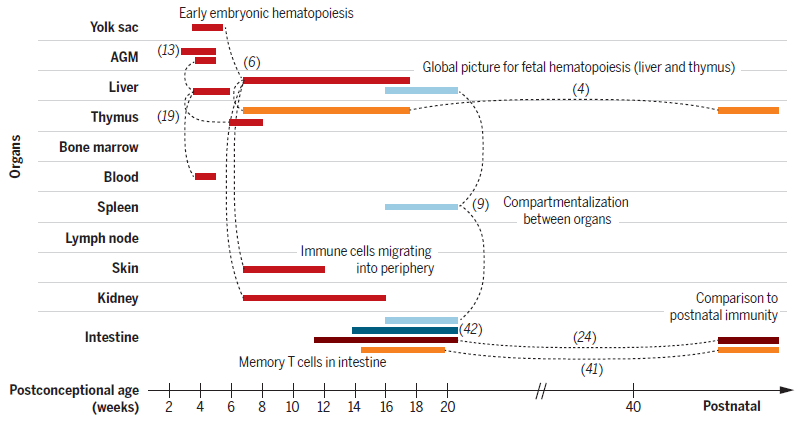
Рис. 2. Обзор Single-cell-мультиомных исследований, детализирующих развитие иммунной системы человека. Разнообразные Single-cell- методы (выделены цветом) были использованы для создания всеобъемлющего атласа развития иммунной системы человека. Во многих исследованиях использовали несколько органов в комплексе для изучения миграции, адаптации и компартментализации клеток иммунной системы. (Исследования обозначены номером цитируемых работ, а пунктирные линии связывают различные органы, отобранные в каждом исследовании.)
К четвертой неделе пренатального развития в эмбриональном желточном мешке человека были обнаружены предшественники гематопоэтических стволовых клеток (ГСК), макрофаги, тучные клетки (mast cells, MCs), предшественники естественных киллеров (NK) и предшественники врожденных лимфоидных клеток (Innate Lymphoid Cells, ILC) наряду с мегакариоцитами и эритроидными клетками. Особое внимание ученых было уделено вопросам происхождения макрофагов, поскольку тканевые макрофаги возникают независимо от ГСК и способны к самообновлению, как следует из работ, проведенных на мышах. Было установлено, что резидентные макрофаги в печени, легких, мозге и эпидермисе происходят из гематопоэтических клеток желточного мешка через эритромиелодных предшественников. В отдельных органах (сердце, легкие, желудок) макрофаги со временем вытесняются моноцитами, происходящими от ГСК. Этот процесс отчасти зависит о того, насколько "открытыми" остаются ниши для циркулирующих клеток. У человека тканеспецифичные макрофаги обнаруживаются уже на самых ранних стадиях развития (с 6-й недели). Singlе-cell анализ аорто-гонадо-мезонефроса человека позволил обнаружить особую популяцию гемогенного эндотелия, который дает начало макрофагам. Сравнительный транскрипционный анализ макрофагов в разных локусах позволил охарактеризовать разнообразие макрофагов, необходимых для развития, например, эритроидных островков или печени. В развитии человека возникновение MCs связано как с желточным мешком, так и с печенью. Профиль экспрессии генов MCs оказался схожим у клеток из кожи, почек и печени плода. Остается пока неясным, какую функцию выполняют так рано появляющиеся в развитии MCs. Предполагают, что они важны для формирования соединительной ткани и ангиогенеза.
NK-клетки, врожденные лимфоидные клетки и их общие лимфоидные предшественники были обнаружены в желточном мешке и эмбриональной печени. На более поздних стадиях эмбриогенеза эти клетки выявляются во многих органах плода в более дифференцированной форме. Понимание, какую роль играют NK-клетки у плода, остается ограниченным. Хотя они считаются незрелыми и гипореактивными по сравнению с NK-клетками у взрослых, они уже обладают киллерной активностью, и по-видимому, способны отвечать за такие стимулы, как вирусные инфекции. NK-клетки с цитолитическими гранулами обнаружены в значительных количествах в кишечнике плодов, и их способность к дегрануляции выше, чем таковая у взрослого человека. Помимо NK-клеток, ткани плода содержат большое количество других ILC. Интересно, что их число снижается после рождения. Среди них выявлены клетки, индуцирующие лимфоидную ткань (Lymphoid tissue inducer, LTi), которые необходимы для формирования вторичных лимфоидных органов. ILC появляются в человеческом эмбрионе очень рано и участвуют как в защите, так и в ремоделировании тканей. Это самая ранняя волна гемопоэза из желточного мешка оснащает эмбрион базовым репертуаром врожденных иммунных эффекторов. Точная роль этих клеток в развитии тканей и контрольные точки, которые предотвращают нарушения в иммунной системе в процессе внутриутробного развития, требуют дальнейшего изучения.
Дефинитивные ГСК способны генерировать полный набор эритроидных, мегакариоцитарных, миелоидных, и лимфоидных клеток в эмбриональной печени, однако нейтрофилы возникают только после установления гемопоэза в костном мозге. В отличие от макрофагов, моноциты и дендритные клетки (ДК) считаются ГСК-зависимыми популяциями. У мышей они образуются из общего клоногенного предшественника.
В развитии человека первые признаки образования ДК обнаружены в печени около 6-й недели. Обычные ДК1, ДК2 и плазмацитоидные ДК выявлены в значительном количестве в разных тканях плода, включая легкие, селезенку, кожу и тимус, начиная с 12-й недели. Эмбриональные ДК, подобно их взрослым собратьям, способны мигрировать, реагировать на лигирование Toll-подобных рецепторов, а также стимулировать пролиферацию и активацию Т-клеток. Эмбриональные ДК обладают особой способностью индуцировать дифференцировку регуляторных Т-клеток, что свидетельствует о важной роли ДК в поддержании толерантности в эмбриональном развитии человека.
В-клетки впервые появляются в печени на 7-й неделе в виде предшественников. Зрелые В-клетки появляются к 9-й неделе. Это связывают с изменением потенциала ГСК для генерации В-клеток и формированием микроокружения в эмбриональной печени, необходимого для поддержания дифференцировки В-клеток. К середине эмбрионального периода развития главным источником В-клеток становится костный мозг, а зрелые В-клетки в изобилии представлены в селезенке. Хотя разнообразие репертуара В-клеток формируется уже на ранних стадиях развития, активное формирование герминативных центров во вторичных лимфоидных органах приторможено до встречи с антигеном после рождения. Анализ репертуара рецепторов В-клеток из кишечника плодов второго триместра и новорожденных показал, что плодовые В-клетки представлены в первую очередь фолликулярными и переходными, в то время как плазматические клетки выявляются в больших количествах после рождения. Пока не решена задача четкой идентификации В1-лимфоцитов у плода человека. Дальнейшие усилия по созданию атласа клеток эмбрионального костного мозга человека необходимы для лучшего понимания онтологии В-клеток.
Тимус обеспечивает среду, необходимую для дифференцировки Т-клеток. Ранние лимфоидные предшественники мигрируют из печени плода в тимус около 8-й недели, где они развиваются в наивные Т-лимфоциты. Формирование тимуса обеспечено взаимодействием между стромальными клетками тимуса и лимфоидными предшественниками, которое было подробно изучено на грызунах. Комплексный анализ клеточного транскриптома компонентов развивающегося тимуса человека выявил обширную связь между эпителиальными клетками тимуса, клетками мезенхимы, ранними предшественниками, дифференцирующимися и зрелыми Т-клетками. Соотношение разных клеточных популяций также отражает скоординированные изменения в процессе развития, что еще раз доказывает важность правильного баланса различных клеток для созревания органа. Single-cell-мультиомные исследования печени и тимуса плода позволили установить подробные молекулярные механизмы, объясняющие переход от ранних предшественников тимуса к наивным Т-клеткам. Ху и его коллеги сосредоточились на молекулярном профиле предшественников, заселяющих тимус. Авторы обзора расширили этот анализ до более поздних стадий развития. Совокупность этих результатов позволила установить непрерывную цепочку превращений от ранних тимусных предшественников до множественных зрелых форм Т-лимфоцитов. Наивные Т-клетки покидают тимус и мигрируют в другие ткани. Циркулирующие Т-клетки обнаружены у человека к 10-11-й неделе. Вопрос присутствия микроорганизмов во внутриутробном пространстве остается предметом дискуссий. Хотя в норме плод, скорее всего, стерилен, ненаследуемые материнские аллоантигены и микробные продукты могут потенциально активировать иммунную систему плода. Чтобы избежать нарушения аллореактивности, плод должен поддерживать толерогенный иммунитет. Следовательно, наивные Т-клетки, образующиеся у плода, с большей вероятностью развиваются в направлении регуляторных Т-клеток по сравнению со взрослыми наивными Т-клетками. Эмбриональные регуляторные Т-клетки подавляют пролиферацию и секрецию цитокинов другими Т-клетками, которые являются потенциально аутореактивными.
Т-клетки памяти были идентифицированы в кишечнике плода, что подтверждает способность фетальных Т-клеток реагировать на чужеродные антигены. Исследования кишечных CD4+ Т-клеток с помощью Single-cell-мультиомных методов в сочетании с секвенированием выявили существование популяций Т-клеток памяти и регуляторных Т-клеток с признаками клональной экспансии, подчеркивая баланс между активацией и угнетением адаптивного иммунного ответа у плода. Таким образом, адаптивный иммунитет плода оказался значительно более зрелым, чем полагали ранее. Необходимы дальнейшие исследования, касающиеся вопросов о том, какие антигенные сигналы лежат в основе активации эмбриональных Т-клеток, и какую роль они играют в развитии и защите плода. Пространственно-временной анализ формирования иммунной системы плода позволил выявить отличительные свойства клеток врожденного и адаптивного иммунитета, по сравнению с их взрослыми аналогами.
Заключение
Современная Single-cell-мультиомика и пространственно-ориентированные технологии обеспечили идеальный базис для изучения и реконструкции развивающейся иммунной системы человека. Многие вопросы в этой области еще предстоит изучить. Как изменяются гемопоэтические предшественники на протяжении всего развития? Как различные тканевые ниши, такие как желточный мешок, печень, БМ, тимус и селезенка, влияют на популяцию предшественников и развитие клеток иммунной системы? Как лимфоидные клетки мигрируют в периферические нелимфоидные ткани и адаптируются к ним? Как иммунная система взаимодействует, учится и формирует память для будущих встреч с антигеном?
Изучение формирования иммунной системы в онтогенезе имеет большое практическое значение. Нарушения в развитии эмбриональных гемопоэтических клеток-предшественников в настоящее время признаны вероятной причиной возникновения онкологических заболеваний, включая острый мегакариобластный лейкоз, ассоциированный с синдромом Дауна, ювенильный миеломоноцитарный лейкоз и острый лимфобластный лейкоз младенцев. Ранние первичные иммунодефициты и / или аутоиммунные заболевания также могут быть связаны с нарушением процесса развития. В этих условиях аберрантный гемопоэз также приводит к нарушению иммунной функции. Глубокое понимание закономерностей развития иммунной системы обещает революцию в трансплантации стволовых клеток и тканевой инженерии для иммунотерапии и регенеративной медицины в ближайшем будущем.
Новость подготовилa © Мельникова В.И.
09.06.2020