 © Карпова Ярослава Дмитриевна, научный сотрудник лаборатории БИОХИМИИ ПРОЦЕССОВ ОНТОГЕНЕЗА. Кандидат биологических наук.
© Карпова Ярослава Дмитриевна, научный сотрудник лаборатории БИОХИМИИ ПРОЦЕССОВ ОНТОГЕНЕЗА. Кандидат биологических наук.Область научных интересов: протеасомы в развитии иммунной системы и клеточной малигнизации.
Одним из критических этапов при хирургическом лечении рака прямой кишки является определение длины прилегающего к опухоли участка кишечника, так же подлежащего удалению. Если удаленный участок будет мал, может повыситься риск рецидива заболевания. Если же проведенная операция будет слишком обширна, восстановление и качество жизни пациента будет ухудшено.
Для неограниченного роста аденокарциномы необходимо активное использование протеасомального комплекса, многофункциональной фабрики гидролиза внутриклеточных белков. Мы предположили, что изменение в пуле протеасом, обеспечивающее безостановочное деления клеток опухоли, может служить надежным молекулярным маркером опухоли и помочь отличить интактный прилегающий кишечник от злокачественной ткани. Для этого мы исследовали 54 образца аденокарциномы прямой кишки от разных пациентов, а также соответствующие проксимально и дистально удаленные от опухоли участки кишечника. Кроме конститутивных протеасом, необходимых для базового протеолиза белков, в клетках человека могут присутствовать другие формы протеасом, отличающиеся комбинацией разных протеолитических субъединиц и активаторов. Таким образом, пул протеасом конкретной клетки или ткани определяет как изменение общего количества протеасом, так и вариации в содержании различных форм протеасом, все вместе определяющие активность протеолиза.
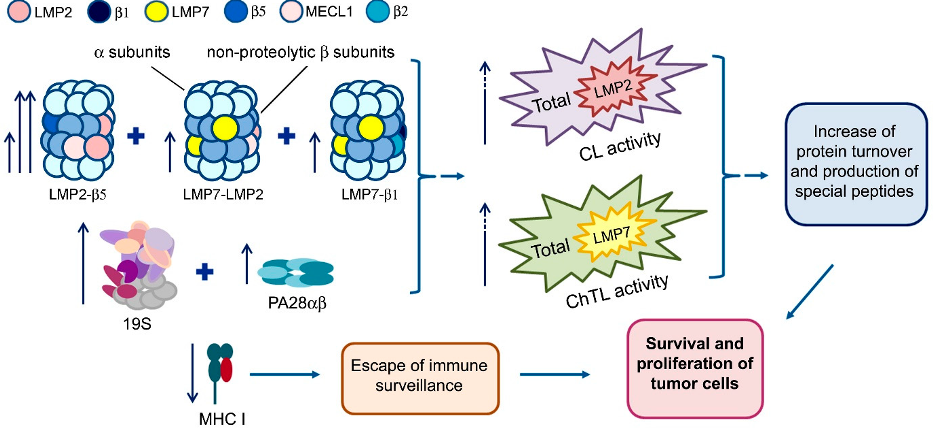
Мы применили комплексный подход к изучению функционирования протеасом, который помог нам четко определить специфичный молекулярный отпечаток, характерный для аденокарциномы. Была исследована общая активность пула протеасом и показано значительное увеличение активностей протеасом в новообразованной ткани. С помощью вестрн блоттинга было продемонстировано, что данное увеличение определяется как увеличением общего количества потеасом, так и вероятным доминированием одной из форм протеасом, содержащей в своем составе протеолитическую субъединицу LMP2 и активатор PA28αβ.
Основной проблемой при таком способе оценки разных форм протеасом является тот факт, что пробоподготовка требует разделения всех протеасом на субтипы и детекцию их «в смеси». Для того чтобы определить в каких именно комбинациях представлены исследуемые формы протеасом в раковых клетках и какими из них определяется увеличение общей активности, мы применили метод нативного электрофореза, разработанный в нашей лаборатории специально для исследования неочищенных протеасом. Действительно, нам удалось показать, что на фоне общего увеличения количества протеасом в раковых клетках значительно увеличивается содержание протеасом с субъединицей LMP2 и активатором PA28αβ, что обусловливает изменение соответствующей каспаза-подобной активности протеасом. Данные изменения протеасомного пула были характерны для всех исследуемых образцов аденокарциномы при сравнении с контрольным максимально удаленным участком кишечника.
Но что же происходит в более приближенных к опухоли участках? Проведенный анализ активности протеасом и изменения содержания их форм выявил «нормальный» статус проб кишечника уже на расстоянии 2см от опухоли. Эти результаты могут служить важным аргументом при составлении протоколов хирургического удаления аденокарциномы прямого кишечника и доводом в пользу сохранения сфинктера.
Результаты настоящей работы не только помогают лучше понять механизм развития раковой опухоли, но и открывают новые направления в развитии противоопухолевой терапии. Современные методы лечения рака с помощью ингибиторов протеасом нацелены на подавление общего протеасомального пула. И поскольку протеасомы играют важнейшую роль в нормальном функционировании любой клетки в организме, подобная химиотерапия имеет огромное количество побочных эффектов и практически убивает не только опухоль, но и самого человека. Результаты же нашей работы подсказывают возможность более специализированного и узконаправленного подхода, основанного на ингибировании специфической формы протеасомы, содержащей субъединицу LMP2 и активатор PA28αβ, которые слабо представлены или отсутствуют в большинстве нормальных клетках.
Какие же протеасомные механизмы лежат в основе поддержки роста и развития опухоли? Какие преимущества получает раковая клетка за счет появления уникальной формы протеасомы?
(1) Образование новых форм протеасом с субъединицей LMP2 увеличивается более, чем в три раза. (2) Образование новых форм протеасом с субъединицей LMP7, не превышающего по соотношения к общему пулу это значение в контрольной ткани. (3) Дополнительная экспрессия 19S и PA28αβ активаторов протеасом. (4) Увеличение общего пула протеасом. (5) Увеличение химотрипсин- / каспаза-подобных и LMP2 / LMP7 ассоциированных активностей протеасом, в особенности LMP2 активность протеасом с активатором PA28αβ. (6) Уменьшение экспрессии главного комплекса гистосовестимости класса I.
Новость подготовила © Карпова Я.Д.
09.04.2021