

Каждая реакция клетки на изменения в микроокружении, будь то воспалительный ответ или индукция дифференцировки, ассоциирована со сменой профиля экспрессии специализированных белков. Сигнальные каскады, запускаемые рецепторами на мембране, передают сигнал по цепи к транскрипционным факторам, связывающим ДНК, напрямую вовлеченным в инициацию или подавление экспрессии генов-мишеней. Транскрипционные факторы как правило состоят из одного или нескольких ДНК- связывающих и активационных доменов. ДНК-связывающие домены отвечают за специфичность взаимодействия с регуляторными элементами генома, такими как промоторные или энхансерные области. Активационные домены часто имеют неупорядоченную структуру (intrinsically disordered regions, IDR). Неупорядоченные домены присутствуют у значительной части транскрипционных факторов и коактиваторов и способствуют их кооперации посредством формирования водородных связей, электростатических или гидрофобных взаимодействий. Транскрипционные факторы с такими доменами способны формировать особые конденсаты на основе жидко- жидкостного разделения фаз. В настоящее время формирование конденсатов считается важным аспектом инициации транскрипции (рис.1) (Boija et al., 2018; Shukla et al., 2022).
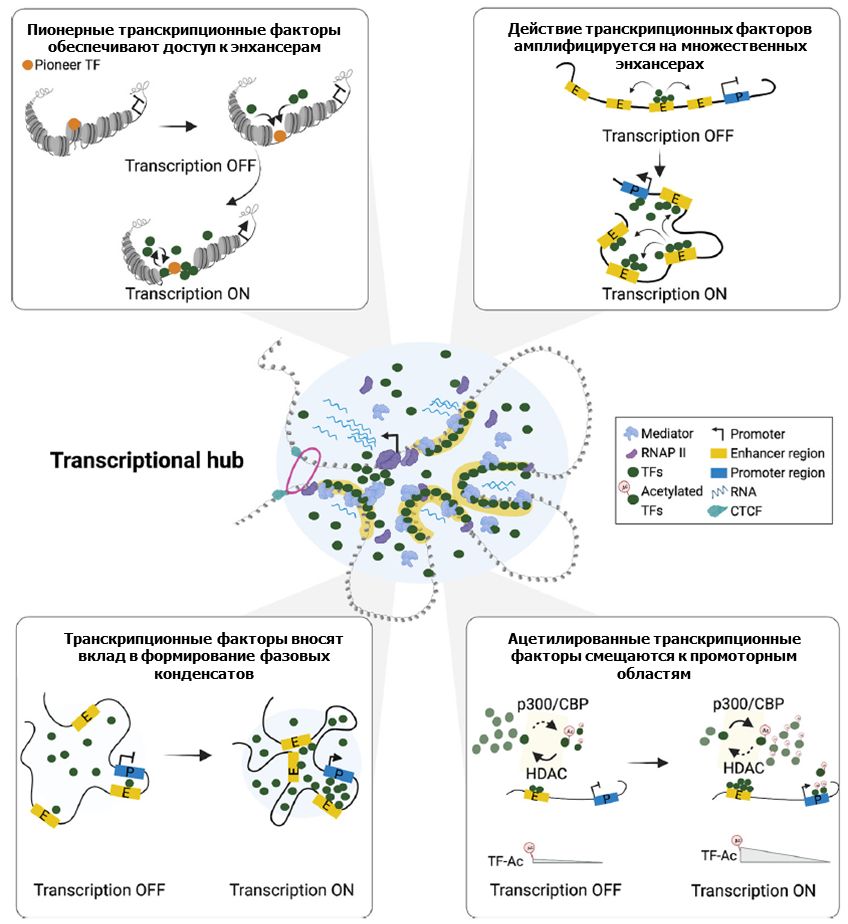
Рис. 1. Предположительные механизмы формирования транскрипционного хаба посредством транскрипционных факторов. Левая верхняя панель: пионерные транскрипционные факторы связывают ДНК на нуклеосомах и стимулируют ремоделинг хроматина, делая его более доступным для других транскрипционных факторов. Кооперативная работа множества транскрипционных факторов приводит к активации энхансера. Верхняя правая панель: связывание транскрипционных факторов с энхансерами может стимулировать к усилению аналогичного связывания с близкими энхансерами. Нижняя левая панель: слабые мультивалентные взаимодействия доменов с неупорядоченной структурой транскрипционных факторов и комплексов, находящихся на энхансерах и промоторах, может приводить к формированию фазовых конденсатов. Нижняя правая панель: Модель градиента активности транскрипционных факторов, предполагающая, что посттрансляционно-модифицированные транскрипционные факторы могут распространяться на соседние промоторы по принципу градиента (Shukla et al., 2022)
Способность формировать конденсаты на основе жидко-жидкостного взаимодействия была выявлена для членов сигнального каскада YAP/TAZ/TEAD. Членов этого каскада часто включают в сигнальный путь Hippo (рис.2), активация которого приводит к фосфорилированию YAP/TAZ и их деградации в цитоплазме. Когда этот каскад инактивирован, YAP1 и TAZ транслоцируются в ядро, где связывают транскрипционные факторы семейства TEAD и запускают транскрипционную программу, контролирующую процессы клеточной дифференцировки, поддержания стволового состояния пролиферацию, миграцию и т. д., в зависимости от клеточного контекста. Помимо каскада Hippo в регуляцию сигнального пути YAP/TAZ/TEAD вовлечены пути NOTCH, WNT и др. Сигнальный каскад YAP/TAZ/TEAD часто оверактивирован при канцерогенезе.
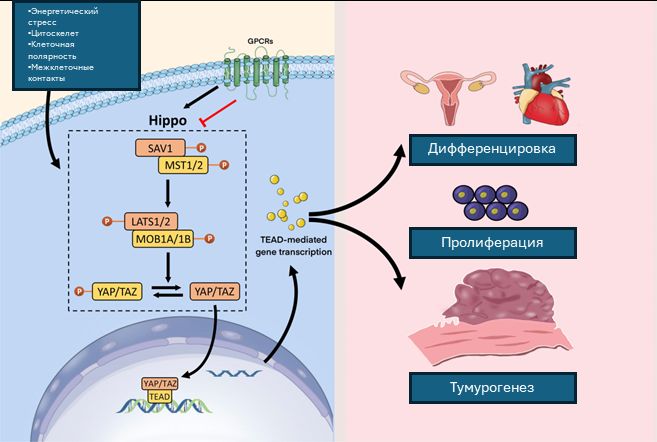
Рис. 2. Сигнальный каскад Hippo. Активация каскада зависит от целого спектра внешних сигналов, в том числе изменений в структуре цитоскелета, различных рецепторов, ассоциированных с G-белками (GPCR), энергетического стресса, формирования межклеточных контактов и клеточной полярности. При активном каскаде Hippo комплекс MST1/2-SAV1 фосфорилирует LATS1/2-MOB1A/B, которые в свою очередь фосфорилируют YAP/TAZ. В случае супрессии каскада Hippo, YAP/TAZ транслоцируются в ядро, связывают транскрипционные факторы TEAD, что стимулирует TEAD-опосредованную транскрипцию генов-мишеней (Shen et al., 2023) .
YAP1 способен к формированию конденсатов только в стрессовых условиях: при гиперосмотическом шоке или при обработке INFγ (Cai et al., 2019; Hao et al., 2022; Yu et al., 2021) . В то же время способность к жидко-жидкостному разделению фаз была показана для TAZ в обычных условиях. Конденсаты этого транскрипционного кофактора содержали TEAD4, а также коактиваторы BRD4 и MED1 (Lu et al., 2020) . В приведенной работе Шао, вышедшей в начале 2024 года, выявили важную роль белка FUS в поддержании транскрипционной активности TAZ при формировании конденсатов (Shao et al., 2024).
В первую очередь авторы работы изучили набор белков, с которым контактирует TAZ при формировании конденсатов. Для этого использовали метод масс-спектрометрии с кросс- линкером, при этом кросс-линкер специально улучшили для этой задачи. Для изучения интерактома конденсаты, состоящие из рекомбинантного белка GFP-TAZ, получали in vitro совместно с экстрактом ядер клеток HeLa (рис.3а). Наблюдали как формирование конденсатных капель из GFP-TAZ, так и их разрушение под воздействием 1,6- гександиола (рис.3b). Протеомный анализ выявил 63 и 21 белок , взаимодействующий с TAZ, в условиях формирования конденсатов и при их разрушении 1,6-гександиолом соответственно, из них 16 белков встречались в обоих состояниях (рис.3с). Анализ показал, что в условиях жидко-жидкостного разделения фаз TAZ контактирует с белками, отвечающими за связывание РНК, сплайсинг, процессинг, иммунный ответ и репарацию (рис. 3d). Также выявили, что в условиях разделения фаз комплексы с TAZ были обогащены FUS и CDK9 (рис.3e). Формирование комплексов с этими белками дополнительно подтвердили вестерн-блотом (рис.3f). В дальнейшей работе авторы сконцентрировались именно на функциях FUS.
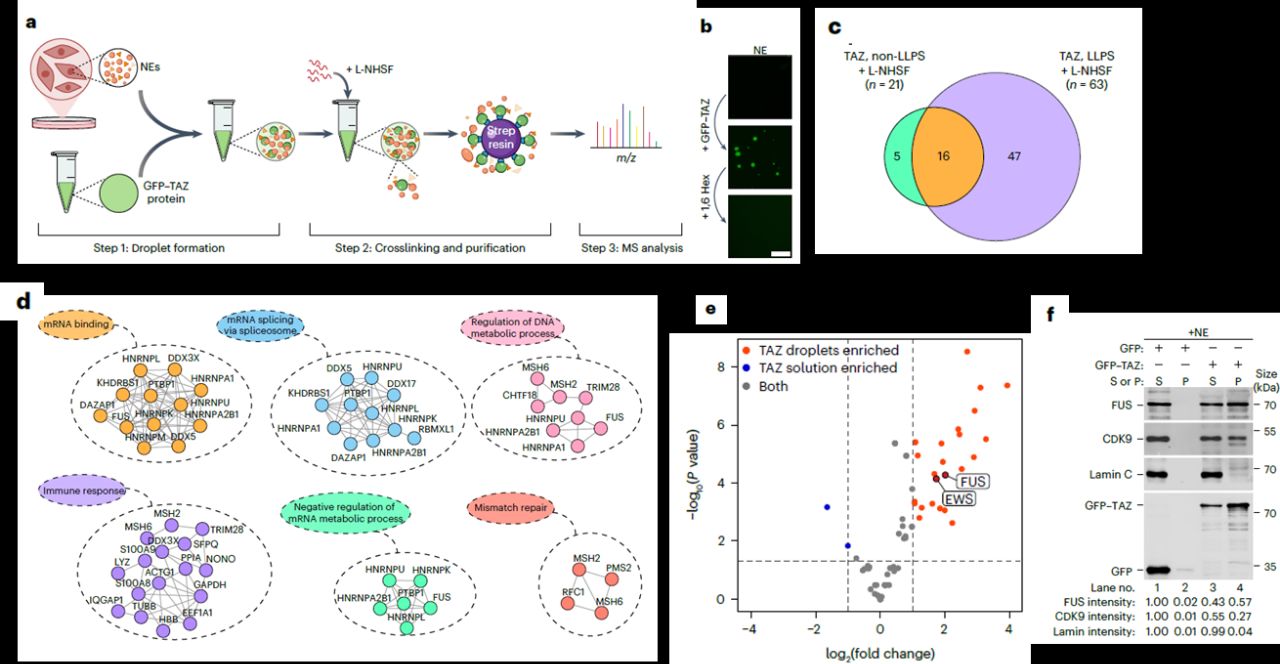
Рис. 3. Анализ интерактома TAZ в конденсатах. а. Дизайн эксперимента. Рекомбинантный GFP-TAZ смешали с ядерным экстрактом (NE) для индукции формирования конденсатов, затем сшивали с разработанным кросслинкером (L-NHSF) для стабилизации межмолекулярных взаимодействий внутри конденсатов. Конденсаты далее очищали и анализировали методом жидкостной хроматографии и масс- спектрометрии для определения связанных белков. b. GFP–TAZ и 1,6-гександиол (5%) (1,6 Hex) смешивали с ядерным экстрактом для анализа динамики формирования конденсатов. Масштабный отрезок 50 µm. с. Диаграмма Виенна, демонстрирующая количество белков, ассоциированных с TAZ в условиях фазовой сепарации и ее отсутствии. d. Сеть функциональных взаимодействий белков, ассоциированных с конденсатами TAZ. Взаимодействия рассчитаны на основе базы данных STRING. е. График рассеяния данных на основании выявленных белков. Ось х - log2(fold change) частоты встречаемости TAZ в интерактоме в условиях фазового разделения в сравнении с отсутствием фазового разделения. Значительно представленные белки обозначены красным и синим. f. GFP или GFP–TAZ, смешанные с ядерным экстрактом, были использованы для ко-седиментации в условиях формирования конденсатов и проанализированы методом вестерн-блоттинга.
Оверэкспрессия FUS препятствовала формированию капель из GFP-TAZ (рис.4а), в то время как его нокдаун стимулировал формирование конденсатов (рис.4b). Аналогичный эффект обнаружили при стимуляции формирования конденсатов белка YAP. Исследования влияния белка FUS на формирование конденсатов GFP-TAZ на фоне активации и ингибирования каскада Hippo показало, что взаимодействие между FUS и TAZ не зависит от этого каскада.
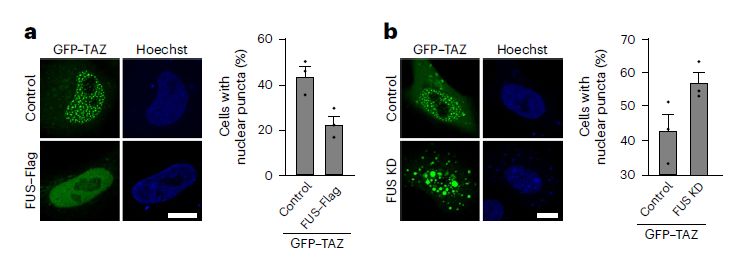
Рис. 4. FUS препятствует фазовой сепарации TAZ. a. Изображения (слева) и количественный обсчет (справа) клеток, несущих GFP–TAZ одиночно или совместно с FUS. b. Изображения (слева) или количественный обсчет (справа) влияния нокдауна FUS на формирование конденсатов GFP-TAZ.
Авторы получали различные модифицированные варианты белка FUS, чтобы исследовать механизм его взаимодействия с TAZ. Удаление домена LCD (low complexity sequence domain) блокировало взаимодействие FUS-TAZ. Далее путем мутагенеза этого домена, а также серией дополнительных экспериментов с модуляцией активности фосфатаз и ДНК связанных протеинкиназ, было выявлено, что фосфорилирование LCD препятствует его инкорпорированию в конденсаты TAZ.
Еще при протеомном анализе была предсказана важность домена CC (coiled-coil) белка TAZ для взаимодействия с FUS. Методом конфокальной микроскопии выявили, что GFP- FUS-LCD колокализуется с mCherry-CC, но не с mCherry-WW, другим доменом белка TAZ (рис. 5 a,b). Результаты подтвердили анализом FRET (флуоресцентно-резонансный трансфер энергии), где СFP-TAZ, в качестве донора, передавал энергию YFP-FUS, только при взаимодействии с нативным белком, но не при делеции CC-домена (рис.5c).
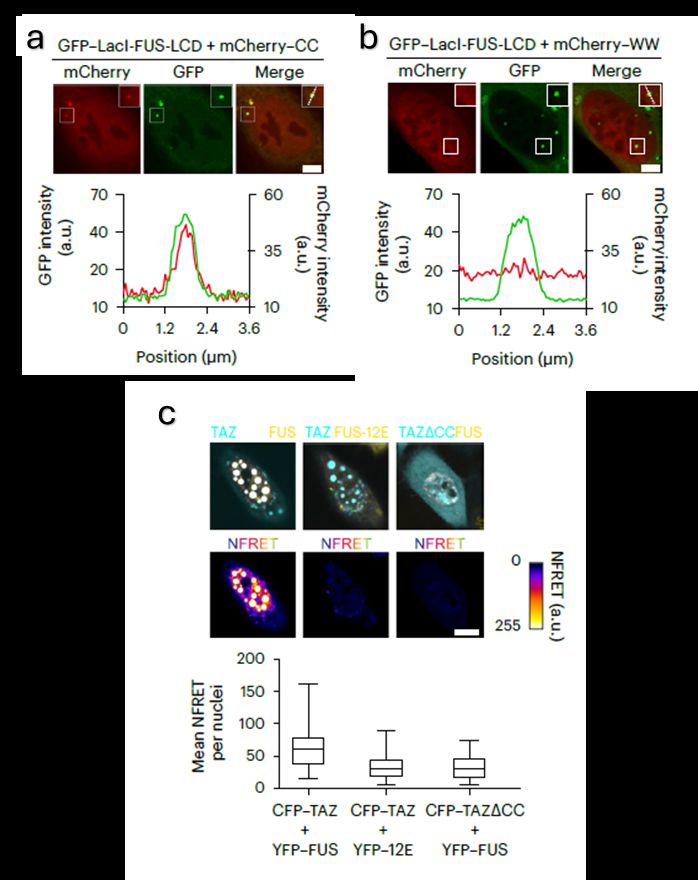
Рис. 5. FUS-LCD взаимодействует с СС-доменом TAZ для формирования конденсатов. a,b. U2OS-LacO клетки, трансфецированные GFP–LacI-FUS-LCD совместно с mCherry–CC (а) или mCherry–WW (b) и исследованные методом конфокальной микроскопии. Внизу точечные графики изменений интенсивности свечения GFP и mCherry вдоль пунктирной линии на верхнем изображении. с. FRET-микроскопия клеток, экспрессирующих CFP-TAZ и YFP-FUS. Верхняя линия – изображения CFP и YFP. Нижняя линия – нормализованные изображения FRET. Нижний график демонстрирует нормализованные результаты FRET.
Следующей поставленной целью было определение функций белка FUS, которые он выполняет в конденсатах, образованных TAZ. Авторы обратили внимание, что капли, образованные TAZ, при инкубации с mCherry-FUS-LCD имеют округлую форму, однако в контрольных условиях формируют структуры, напоминающие агрегаты (рис. 6а). Конденсаты, сформированные посредством разделения фаз, могут переходить из жидкого состояния в гелеобразное и даже твердое. Авторы провели анализ восстановления флуоресценции (FRAP), который выявил большую подвижность TAZ в присутствии FUS (рис.6 b,с). Последующие эксперименты показали, что FUS делает конденсаты TAZ более чувствительными к агенту, разрушающему фазовые переходы. Нокдаун FUS приводил к обратным эффектам. Дополнительно авторы исследовали белки, также входящие в конденсаты TAZ: TEAD4, CycT1 и BRD4. Нокдаун FUS также снижал и их подвижность. Таким образом FUS сохранял жидкое состояние конденсатов TAZ, что также способствовало инкорпорированию других белков в эти конденсаты.
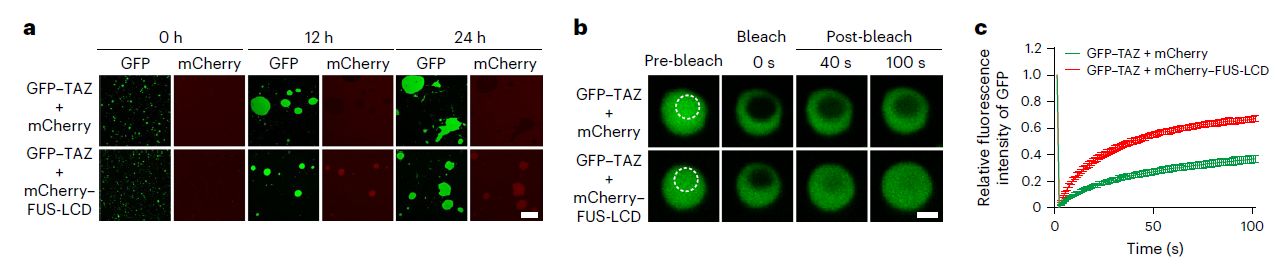
Рис. 6. FUS способствует поддержанию жидкостного состояния конденсатов TAZ. а. Изображения конденсатов GFP-TAZ совместно с mCherry (контроль) и mCherry-FUS-LCD, полученные методом конфокальной микроскопии на различных сроках. b. FRAP конденсатов, сформированных GFP-TAZ совместно с mCherry (контроль) и mCherry-FUS-LCD. Изображения на разных сроках восстановления свечения. с. График, описывающий динамику восстановления флуоресценции.
Подобное жидкое состояние конденсатов важно для эффективного взаимодействия между транскрипционными факторами и другими белками в конденсатах, что в свою очередь необходимо для активации транскрипции. Клеточную линию, содержащую YAP- и TAZ-чувствительный репортер, использовали для оценки влияния подавления и оверэкспрессии FUS на экспрессию YAP/TAZ-зависимых мишеней (рис.7a,7b). Оверэкспрессия FUS значительно увеличивает уровень экспрессии мишеней, в то время как его нокаут оказывает эффект, сравнимый с нокаутом TAZ. Далее при работе с линией MCF10 с оверэкспрессией TAZ авторы обнаружили 588 зависимых от TAZ мишеней (рис. 7с), экспрессия которых значительно подавляется нокдауном FUS (рис.7d). FUS оказался вовлеченным в туморогенные свойства TAZ. Изначально нетуморогенная линия MCF10 приобретала такие характеристики при оверэкспрессии TAZ и его нечувствительной к LATS1/2 форме TAZ 4SA. Нокдаун FUS подавлял рост колоний туморогенных клеток (рис.7е,7f) и далее снижал интенсивность опухолевого роста при инъекции клеток в иммунодефицитных мышей (рис.7g).
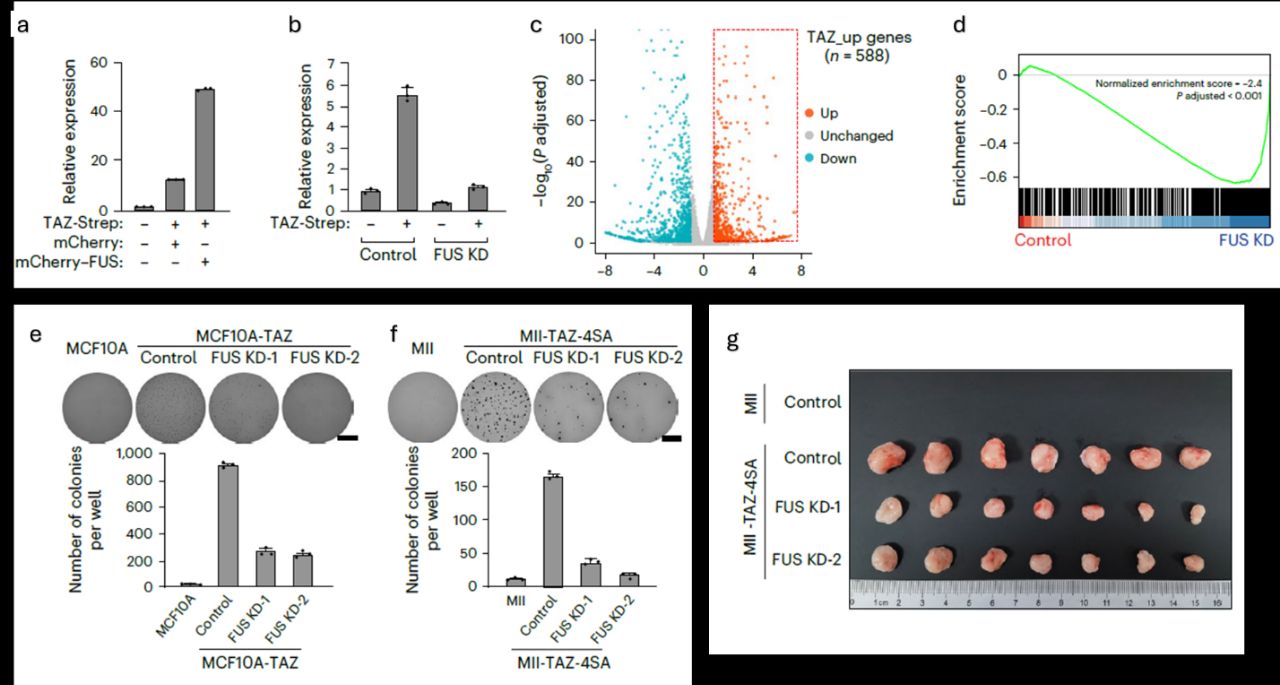
Рис. 7. FUS обеспечивает транскрипционнуюактивность и онкогенность TAZ. a,b. TAZ-зависимая активация экспрессии системы 8×GTIIC-luciferase, измеренная в клетках, трансфецированных TAZ совместно с mCherry (контроль) или mCherry–FUS (a) или при нокдауне FUS (b). с. График рассеяния данных, демонстрирующий дифференциальную экспрессию генов на основании РНК-секвенирования клеток MCF10A и MCF10A-TAZ. d. Анализ генного обогащения с TAZ-опосредованным повышением экспрессии при нокдауне FUS. e,f. Формирование колоний MCF10A и MCF10A-TAZ (MCF10A-TAZ-4SA) с нокдауном FUS в мягком агаре. g. Опухоли, образованные MII-TAZ-4SA клетками на фоне нокдауна FUS.
Кратко свои выводы авторы сформулировали на следующем рисунке (рис.8). FUS необходим для функционирования конденсатов белка TAZ и инициации транскрипции генов-мишеней. LCD-домен FUS взаимодействует с CC-доменом TAZ, сохраняя жидкое состояние конденсатов.
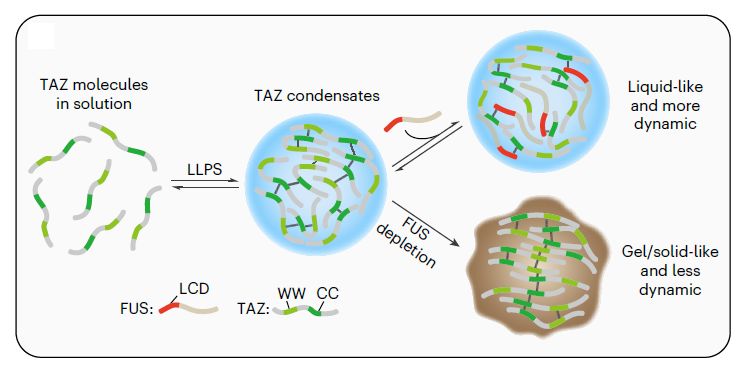
Рис. 8. Предполагаемая модель регуляции фазовой сепарации посредством FUS.
Сигнальному каскаду YAP/TAZ/TEAD отведено значительное место в современной биологии развития, клеточной биологии и регенеративной медицине. Его изучают в контексте раннего эмбрионального развития, тканевых морфогенезов, функционирования стволовых клеток и опухолевой прогрессии при канцерогенезе. Исследование функционирования комплекса YAP/TAZ/TEAD в ядре позволит лучше понять механизмы опосредованной регуляции экспрессии мишеней и взаимной компенсации белков- паралогов при работе этого сигнального каскада. В частности, авторы этого исследования выявили, что при нарушении формирования конденсатов при нокдауне FUS транскрипционный кофактор TAZ не функционирует. Применение вертепорфина оказывало схожее влияние с нокдауном FUS на транскрипцию TAZ-зависимых мишеней. Вертепорфин – ингибитор сигнального пути YAP/TAZ, блокирующий его связывание с транскрипционными факторами TEAD. Такой механизм его действия предполагает, что он может разрушать фазовые конденсаты, сформированные YAP/TAZ/TEAD. Негативное влияние вертепорфина и его аналогов на фазовые переходы было показано в другой работе при исследовании формирования конденсатов из YAP1 (Hao et al., 2022) . Таким образом, поиск агентов, блокирующих конденсацию YAP/TAZ/TEAD может стать новым направлением при разработке средств терапии раковых опухолей. Фазовые переходы при функционировании белков YAP/TAZ/TEAD – дополнительный уровень регуляции, который необходимо учитывать при работе с этим сигнальным каскадом.
Список литературы:
- Boija, A., Klein, I.A., Sabari, B.R., Dall’Agnese, A., Coffey, E.L., Zamudio, A.V., Li, C.H., Shrinivas, K., Manteiga, J.C., Hannett, N.M., Abraham, B.J., Afeyan, L.K., Guo, Y.E., Rimel, J.K., Fant, C.B., Schuijers, J., Lee, T.I., Taatjes, D.J., Young, R.A., 2018. Transcription Factors Activate Genes through the Phase-Separation Capacity of Their Activation Domains. Cell 175, 1842-1855.e16. DOI: 10.1016/j.cell.2018.10.042
- Cai, D., Feliciano, D., Dong, P., Flores, E., Gruebele, M., Porat-Shliom, N., Sukenik, S., Liu, Z., Lippincott-Schwartz, J., 2019. Phase separation of YAP reorganizes genome topology for long-term YAP target gene expression. Nat. Cell Biol. 21, 1578–1589. DOI: 10.1038/s41556-019-0433-z
- Hao, S., Fuehrer, H., Flores, E., Demmerle, J., Lippincott-Schwartz, J., Liu, Z., Sukenik, S., Cai, D., 2022. YAP condensates are highly organized hubs for YAP/TEAD transcription. DOI: 10.1101/2022.10.24.513621
- Lu, Y., Wu, T., Gutman, O., Lu, H., Zhou, Q., Henis, Y.I., Luo, K., 2020. Phase separation of TAZ compartmentalizes the transcription machinery to promote gene expression. Nat. Cell Biol. 22, 453–464. DOI: 10.1038/s41556-020-0485-0
- Shao, Y., Shu, X., Lu, Y., Zhu, W., Li, R., Fu, H., Li, C., Sun, W., Li, Z., Zhang, Y., Cao, X., Ye, X., Ajiboye, E., Zhao, B., Zhang, L., Wu, H., Feng, X.-H., Yang, B., Lu, H., 2024. A chaperone-like function of FUS ensures TAZ condensate dynamics and transcriptional activation. Nat. Cell Biol. 26, 86–99. DOI: 10.1038/s41556-023-01309-3
- Shen, X., Li, Q., Sun, Y., Chen, L., Xue, F., Tian, W., Wang, Y., 2023. The Hippo pathway in endometrial cancer: a potential therapeutic target? Front. Oncol. 13, 1273345. DOI: 10.3389/fonc.2023.1273345
- Shukla, V., Cetnarowska, A., Hyldahl, M., Mandrup, S., 2022. Interplay between regulatory elements and chromatin topology in cellular lineage determination. Trends Genet. TIG 38, 1048–1061. DOI: 10.1016/j.tig.2022.05.011
- Yu, M., Peng, Z., Qin, M., Liu, Y., Wang, J., Zhang, C., Lin, J., Dong, T., Wang, L., Li, S., Yang, Y., Xu, S., Guo, W., Zhang, X., Shi, M., Peng, H., Luo, X., Zhang, H., Zhang, L., Li, Y., Yang, X.-P., Sun, S., 2021. Interferon-γ induces tumor resistance to anti-PD-1 immunotherapy by promoting YAP phase separation. Mol. Cell 81, 1216-1230.e9. DOI: 10.1016/j.molcel.2021.01.010
Новость подготовили
© Е.П. Калабушева
© С.В. Ульянов
09.02.2024