© Куликова Дина Александровна, с.н.с., к.б.н. лаборатории МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ПРОЦЕССОВ РАЗВИТИЯ
© Куликова Дина Александровна, с.н.с., к.б.н. лаборатории МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ПРОЦЕССОВ РАЗВИТИЯОбласть научных интересов: нейроэтология, нейробиология, нейротрансмиттеры, поведение.
Мобильные элементы (МЭ) — это последовательности ДНК, способные перемещаться по геному либо с помощью механизма вырезания и вставки, либо с помощью механизма копирования и вставки. Эти последовательности составляют приблизительно 41% и 48% геномов мыши и человека, соответственно.
С одной стороны, МЭ играют важную роль в эволюции генома, структурной изменчивости, расширении размера генома, пространственной организации, генетическом разнообразии и регуляции генов, а с другой активность МЭ может иметь пагубные последствия, а именно вызывать мутации генов или нарушать их экспрессию. Обычно хозяин контролирует активность МЭ, но этот контроль может нарушаться при некоторых болезнях, например, раке или неврологических расстройствах, а также во время старения. Интересно, что в мозге механизмы подавления также могут частично ослабляться, что позволяет говорить о возможности функциональной роли МЭ в нейрональных сублиниях. Однако, вклад МЭ как в физиологических, так и в патологических процессах в мозге, плохо изучен. В статье авторы суммируют текущие знания об активности МЭ в физиологическом аспекте, особенно уделяя внимание мозгу и старению, а также неврологическим и возрастным расстройствам.
В первой части статьи рассматривается классификация транспозонов, различия в их структуре и способах перемещения по геному, модели достижения тонкого равновесия между экспрессией МЭ и репрессией в геноме хозяина, механизмы репрессии на транкрипционном и посттранскрипционных уровнях (рис.1), а также те изменения, которые могут происходить с помощью МЭ на молекулярном и клеточном уровнях (рис.2).
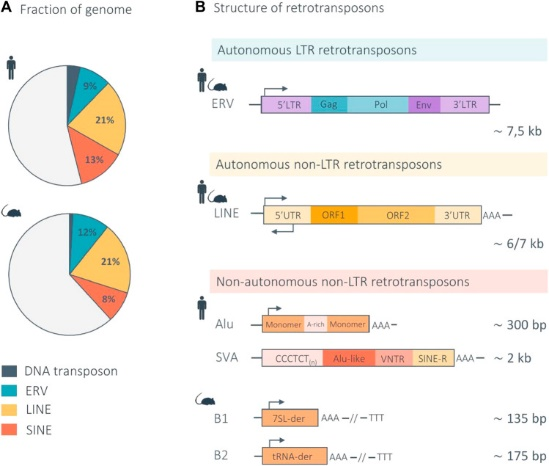
Рис.1 Структура ретротранспозонов и ДНК-транспозонов млекопитающих и соотношение в геноме человека и мыши. (А) Круговые диаграммы показывают соотношение каждого класса ретротранспозонов и ДНК-транспозонов в геноме человека и мыши. (В) Ретротранспозоны делятся на два основных подкласса в соответствии с их механизмом транспозиции: LTR и non-LTR ретротранспозоны. LTR ретротранспозоны, также называемые эндогенными ретровирусами (ERV), являются автономными и имеют сходную организацию в геном человека и мыши. Non-LTR ретротранспозоны делятся на два основных подтипа: автономные LINE (длинные диспергированные повторы) и неавтономные SINE (короткие диспергированные повторы). Структура LINE человека и мыши аналогична. Основными SINE в геноме человека являются Alu и SVA, а в геноме мыши – B1 и В2. Стрелки показывают приблизительное положение и ориентацию промотора для каждого элемента. (Waterston et al., 2002; Richardson et al., 2015; Deniz et al., 2019; Hoyt et all., 2022).
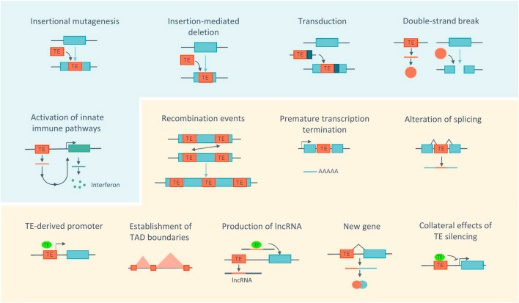
Рис.2 Процессы, связанные с активностью МЭ, происходящие на молекулярном и клеточном уровнях. Активно перемещающиеся МЭ могут быть причиной нестабильности генома, вызывая мутации, делеции, трансдукцию или повреждения ДНК. Накопление продуктов из МЭ может вызвать воспаление. Даже не будучи активными, МЭ обладают способностью изменять геном хозяина, способствуя событиям рекомбинации, изменению транскрипции, регуляции экспрессии генов и изменению трехмерной архитектуры хроматина. Адаптировано из (Cordaux and Batzer, 2009; Sundaram and Wysocka, 2020; Fuevo et al., 2022).
Наибольший интерес представляет собой вторая часть обзора, посвященная активности МЭ в здоровом мозге, при старении, а также при различных неврологических расстройствах. Известно, что большинство МЭ не перемещаются в соматических тканях, но, оказалось, что в мозге это не так. Перемещение МЭ в процессе развития нейрональной ткани способствует установлению нейронального мозаицизма. Секвенирование отдельных нейронов человека показало, что частота уникальных вставок в отдельных нейронах находится в диапозоне от 0,6 до 13,7. Такие индивидуальные различия в нейронах имеют важные последствия для нейрональной пластичности и разнообразия отдельных подгрупп нейронов. Однако, функциональное значение таких различий остается дискуссионным вопросом.
Физиологическое старение – еще один процесс, связанный с нарушением активности МЭ. Известно, что на молекулярном уровне старение сопровождается обширными эпигенетическими изменениями в модификациях гистонов и паттернах метилирования ДНК, а также глобальной потерей и перераспределением гетерохроматина. Эти эпигенетические изменения влияют в свою очередь на экспрессию и мобилизацию МЭ. В стареющих фибробластах человека была обнаружена повышенная экспрессия эволюционно молодых подсемейств МЭ Alu, SVA и LINE-1. Аналогичные изменения были зарегистрированы в соматических клетках печени и мышц старых мышей для различных подсемейств ретротранспозонов. Помимо глобальных эпигенетических изменений было показано, что связывание сиртуина-6 (SIRT6), сильного репрессора элементов LINE-1, снижается при старении. Это поднимает вопрос: повышенная транскрипция и транспозиции МЭ – это следствие старения или одна из причин? Повышенная транспозиция МЭ приводит к увеличению числа повреждений ДНК клетки и геномной нестабильности, связанной со старением. Также были проведены интересные эксперименты, показывающие, что повышенная экспрессия МЭ LINE-1 может приводить к сильному иммунному ответу интерферона типа I, вызывающему стерильное воспаление, которое является одним из отличительных признаков старения. Интересно, что воздействие факторов, увеличивающих продолжительность жизни, показало снижение экспрессии и транспозиции LINE-1 у мышей. Другие недавние исследования продемонстрировали, что еще одно семейство МЭ HERV-K HML-2 может участвовать в процессе клеточного старения, активируя врожденный иммунный ответ. МЭ этого семейства способны продуцировать вирусоподобные частицы, которые могут индуцировать стареющие фенотипы в молодых клетках. Поразительно, но подавление экспрессии этих МЭ при лечении абакавиром привело к замедлению как клеточного старения, так и старения тканей у мышей.
В совокупности эти результаты показывают, что повышенная экспрессия МЭ является отличительной чертой старения. Кроме того, МЭ могут являться ключевыми драйверами клеточного старения, активируя врожденный иммунный ответ.
Следующая часть статьи посвящена подробному разбору, каким образом МЭ могут способствовать развитию конкретных неврологических расстройств или заболеваний, связанных со старением таких как: синдром Ретта, синдром Айкарди-Гутьера, атаксия-телеангиэктазия, боковой амиотрофический склероз, болезнь Альцгеймера и синдромы преждевременного старения различной этиологии.
Данный обзор поднимает сложную и малоисследованную тему вовлеченности МЭ в жизнедеятельность целостного организма. МЭ признаны основными драйверами эволюции генома и генетического разнообразия. Современные исследования показывают также их связь с процессами старения, заболеваниями, вызванными мутациями в различных генах и пластичностью нервной ткани.
Новость подготовила © Куликова Д.А.
08.10.2024