
© Агния Соколова, младший научный сотрудник лаборатории СРАВНИТЕЛЬНОЙ ФИЗИОЛОГИИ РАЗВИТИЯ. Область научных интересов: развитие, систематика и морфология губок.
Абсолютно незыблемые на первый взгляд, губки (тип Porifera) всё же могут совершать определённые движения. Некоторые виды успешно перемещаются в пространстве на небольшие расстояния, другие могут управлять выростами своего тела. Но почти всем свойственны масштабные сокращения и расслабления тела. Со стороны может показаться, что губка «дышит», если, конечно, наблюдатель располагает фотокамерой с таймлапсом, поскольку движения эти весьма неторопливы. Такие «вдохи» и «выдохи» нужны для важного дела – освобождения водоносной системы губок от загрязнения детритом, неизбежного при фильтрующем типе питания. Губки не имеют специализированных мышечных клеток, и за сокращения отвечают пинакоциты – клетки, образующие покровы тела, а также выстилающие водоносные каналы (вводные и выводные) и полости. Известно, что сигнал к сокращению исходит от чувствительных двухжгутиковых клеток, находящихся внутри оскулюма – структуры, через которую отфильтрованная вода организованно покидает тело губки. Эти клетки анализируют поток и выбрасывают в межклеточное пространство молекулу оксида азота NO, сообщая о том, что пришло время прочистить каналы. Но как NO-сигнал трансформируется в мышечное сокращение и как вообще устроены «мышцы» губок, было совершенно не ясно. Авторы свежего исследования, представленного в журнале Nature Communications, существенно приблизились к пониманию этого вопроса, а заодно обнаружили у губок мышечный модуль – совокупность связанных с сокращением генов, регулируемых единым транскрипционным фактором. Поскольку не так давно у губок уже был обнаружен нервный модуль (соответствующую заметку об этой работе от 16.11.2021 г. можно найти на сайте), полученные данные выстраиваются в интересную эволюционную картину. Но, обо всём по порядку.
Два ключевых белка, осуществляющих мышечные сокращения – это актин и скользящий по нему миозин. Молекула миозина включает себя тяжелые и легкие цепи, а их количество зависит от типа миозина. Разный миозин выполняет разные функции, поэтому особый интерес представлял поиск у губок классического мышечного варианта: миозина II, состоящего из двух тяжелых цепей и четырех легких. Авторы обнаружили такой миозин в геноме пресноводного вида Ephydatia muelleri и визуализировали его в пинакоцитах с помощью антител. Распределение миозиновой метки совпало с положением актиновых волокон (рис. 1), а ингибитор сборки актиновых филаментов это распределение нарушал. Значит, миозин действительно сопряжен с актином и, по-видимому, функционален.
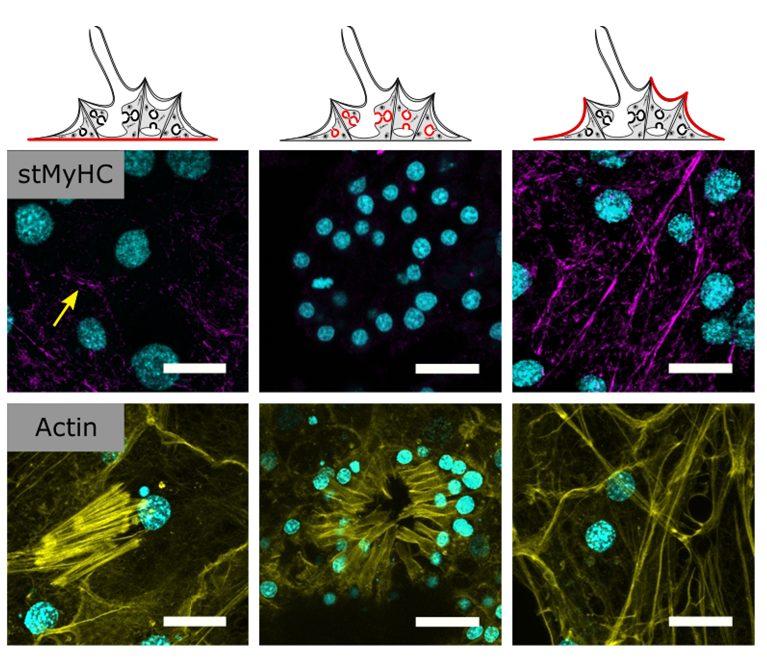
Рис. 1.
Иммунофлуоресцентное маркирование губки антителами к тяжелым цепям классического мышечного миозина (striated-muscle myosin heavy chain). Антитела были получены исходя из соответствующих последовательностей в геноме. Сверху – схема губки, красным выделена ткань, иллюстрации к которой приведены ниже: слева базопинакодерма, по центру – хоанодерма, справа – пинакодерма, выстилающая покровы и вводные водоносные каналы. Масштабная линейка – 10 мкм. Желтая стрелка указывает на границу двух клеток. Циановый цвет маркирует ядра.
Вооружившись этими знаниями, авторы перешли к фармакологическим экспериментам. В качестве модельного объекта они использовали молодых губок, вылупившихся из геммул в лабораторных условиях. Исследователи выяснили, что обработка губок тапсигаргином – блокатором помпы эндоплазматического ретикулума – вызывает точно такие же сокращения (рис. 2Б), как и механическая закупорка водоносной системы чернилами (рис. 2А). По сути, обработка тапсигаргином имитирует высвобождение ионов кальция из внутриклеточного депо в цитоплазму. В норме это происходит, когда клетка воспринимает сигнальную молекулу, такую как NO, ГАМК, глутамат и тп. Авторы показали, что, если заблокировать синтез NO, губка утрачивает способность к сокращению (самоочищению) при механическом коллапсе водоносной системы с помощью чернил (рис. 2Б). Но если губку с заблокированным синтезом NO обработать тапсигаргином, сокращения идут как ни в чём ни бывало (рис. 2Б). Получается, что в естественных условиях события развиваются так: клетки оскулюма чуют, что ток воды, выходящий из губки, уже не первого сорта, и с помощью NO подают сигнал пинакоцитам: пора сокращаться и выкачивать всё лишнее из водоносной системы. Те улавливают сигнал, высвобождают ионы кальция из ЭПР, а дальше… дальше происходит следующий этап регуляции, который нужно изучить отдельно.
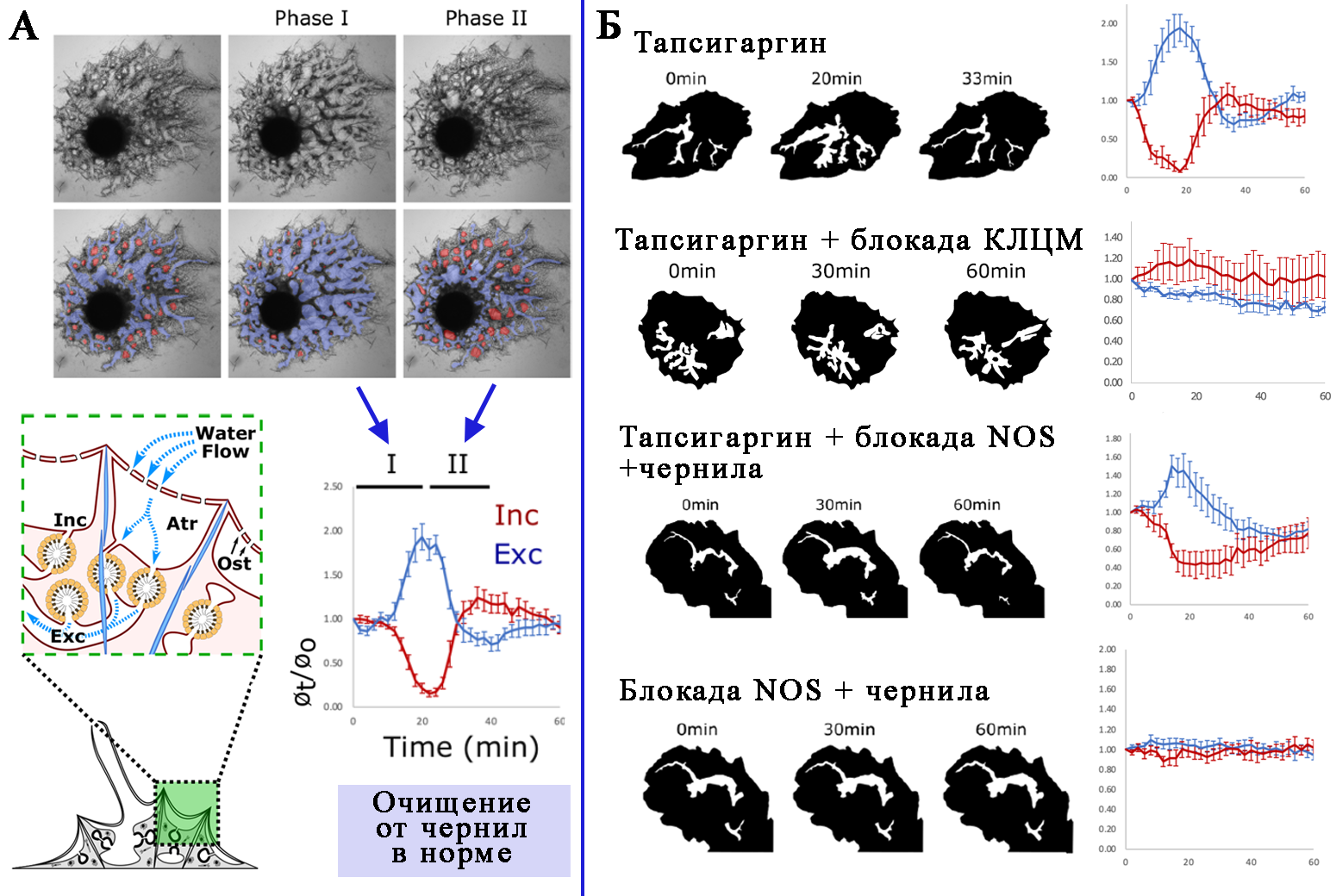
Рис. 2.
Сокращения губки E. muelleri.
А – Самоочищение водоносных каналов от механической закупорки в норме. Сверху – фото одной и той же губки, проходящей через две стадии сокращения. Снизу слева – схема организации водоносной системы губки. Вода проникает во вводные каналы (Inc) через устья (Ost), попадает в хоаноцитные камеры (нарисованы желтым), затем через выводные каналы (Exc) двигается к оскулюму уже отфильтрованная. Снизу справа – график, иллюстрирующий нормальные сокращения губки. По оси ординат отложен условный объём каналов. Во время фазы I (t = 15 мин), вводные каналы (красные) сужаются, а выводные каналы (синие) расширяются. Во время фазы II (t = 36 мин) вводящие каналы расширяются по мере того, как выводящие каналы сужаются.
Б – Сокращения губок в разных экспериментальных условиях. Аббревиатуры: NOS – NO-синтаза, КЛЦМ – киназа лёгких цепей миозина.
Вообще существует два способа регуляции сокращений: с помощью киназы лёгких цепей миозина (КЛЦМ) и с помощью тропонинового комплекса. Последний способ характерен для поперечнополосатых мышц, тогда как первый реализуется в гладких мышцах, а таже в клетках, которые вообще не являются мышечными (например, в эпителии). Регуляция с помощью киназы считается потенциально более древним механизмом и, конечно, выглядит более перспективной в случае губок с их медленными движениями. Работает она так: количество ионов кальция в цитоплазме клетки увеличивается, кальций связывается с белком кальмодулином, это связывание активирует киназу ЛЦМ, которая, в свою очередь, фосфорилирует две легкие цепи миозина из четырёх. Фосфорилирование позволяет миозину связываться с актиновыми филаментами, и происходит сокращение. Авторы исследования взялись искать эту киназу и проверять её функциональность. В геноме E. muelleri были обнаружены гомологи этого фермента, а также гомологи кальмодулина и миозиновых лёгких цепей-мишеней киназы. Если выброс кальция действительно запускает сокращение с помощью киназы ЛЦМ, тогда её блокада будет останавливать сокращения у губок. Авторы обработали блокатором киназы – веществом ML-7 – губок с предварительно заблокированным синтезом NO (рис. 2Б). Теперь губки не могли сокращаться даже после обработки тапсигаргином, и ток воды через их тело останавливался полностью. Значит, одних только ионов кальция недостаточно для сокращения, и их роль здесь ограничена активированием КЛЦМ-каскада. Для полноты картины необходимо было только убедиться, что легкие цепи миозина фосфорилируются во время сокращения. Обработав образцы фаллоидином и антителами к фосфорилированным легким цепям, исследователи отметили, что чем меньше длина актинового волокна, тем больше интенсивность метки, что полностью соотносится с теорией.
Чтобы глубже понять систему управления сократительными пучками губок, авторы решили проверить, регулируются ли гены, вовлеченные в сокращения, транскрипционным кофактором MRTF. У билатерий его гомологи широко распространены, они необходимы для развития и дифференцировки гладкомышечных клеток, т. е. тех, чьи сокращения, как и у губок, запускаются с помощью КЛЦМ. Активность кофактора MRTF регулируется мономерным актином: он связывается с оcобыми аминокислотными повторами кофактора (RPEL-повторами) и ингибирует его. В геноме E. muelleri обнаружился ортолог кофактора c RPEL-повторами, а также его мишень – трансгелин, что уже наводило на мысли о функциональности всей системы. С помощью антител авторы визуализировали эти белки в теле губки и выяснили, что кофактор экспрессируется в цитоплазме археоцитов (мультипотентных клеток) и в ядрах пинакоцитов, а трансгелин – в сократительных пучках пинакоцитов. Обработка губок ингибитором и активаторами кофактора MRTF привела к снижению и увеличению экспрессии трансгелина соответственно. После ингибирования фактора губки хуже справлялись с очищением от чернил, хоть и не теряли полностью способность к сокращениям.
Известно, что у билатерий MRTF влияет на дифференцировку сократительных клеток. Чтобы проверить, справедливо ли это для губок, авторы диссоциировали губок на клетки, отобрали фракцию, обогащенную археоцитами и обработали часть образцов активатором кофактора. Через три дня, когда клетки агрегировали и образовали примморфы, у контрольных экземпляров не обнаружилось сократительных пучков, тогда как у экспериментальных они были. У этих примморфов оказалось больше тяжелых цепей миозина, как показал блоттинг, а ещё тапсигаргин у них вызывал сокращения, тогда как у контрольных – нет. Получается, что и процесс дифференцировки сократительных клеток подчинен весьма консервативной регуляции, связанной с MRTF.
Наконец, авторы получили транскриптомы контрольных примморфов и примморфов, обработанных активатором кофактора. Им удалось обнаружить довольно много генов, чья экспрессия увеличивается в ответ на обработку губок активатором кофактора MRTF. Это гены различных коллагенов, а также гены, задействованные в сокращении (тяжёлые цепи миозина, кальмодулин, трансгелин и т.д.), сигналинге (элементы метаботропных рецепторов глутамата и ГАМК), развитии (myogenic transcription factor SRF, muscle marker Crip/Csrp) и адгезии (интегрины, кадгерины и пр.).
Технически, наличие мышечного модуля в пинакоцитах губок – это не новость: то же было показано для другого пресноводного вида, Spongilla lacustris [1], и морской губки Amphimedon queenslandica [2]. Но главное достоинство работы заключается в экспериментальных данных, показывающих настоящую, а не теоретическую, функциональность сократительной системы и её связь с сигнальной системой.
Поскольку губки – одна из самых базальных ветвей многоклеточных животных, почти любое исследование, связанное с ними, рассматривается в эволюционном контексте. Обсуждаемая работа добавила несколько новых штрихов к картине эволюции Metazoa. Всё менее вероятной кажется идея о том, что губки вторично упрощены, а их предки некогда обладали нервной и мышечной системами. Эпителиоподобная природа сократительных тканей как у губок, так и у книдарий позволяет предположить, что именно такое состояние было предковым, а настоящие миоциты появились позже. Переход от многофункциональных клеток к узкоспециализированным в процессе эволюции выглядит логично. Правда, протомускулатура губок, похоже, не ограничивается акто-миозиновым комплексом в пинакоцитах. Так, опубликованный в прошлом году анализ транскриптомов индивидуальных клеток [1] показал, что в мезохиле – внутреннем пространстве губок, где происходят основные события их жизнедеятельности – имеются клетки, экспрессирующие массу сократительных генов. Эти клетки были названы миопептидоцитами, и их функция пока не ясна.
Кроме того, глядя на геномные и транскриптомные данные разных представителей Holozoa, мы можем наблюдать самые разные «продвинутые» функциональные системы – частично или полностью – не только у губок, но и у филастерей и хоанофлагеллят [1, 3, 4, 5, 6 и др]. По всей видимости, ключевые гены и генетические модули возникли ещё до появления настоящих многоклеточных, подготовив почву для фундаментальных эволюционных преобразований.
1. Musser, J. M., et al. (2021). Profiling cellular diversity in sponges informs animal cell type and nervous system evolution. Science. 374, 717-723
2. Sebé-Pedrós et al. (2018). Early metazoan cell type diversity and the evolution of multicellular gene regulation. Nature Ecology and Evolution. 2, 1176–1188
3. Reyes-Rivera, J., Wu, Y., Guthrie, B. G., Marletta, M. A., King, N., & Brunet, T. (2022). Nitric oxide signaling controls collective contractions in a colonial choanoflagellate. Current Biology. 32, 2539-2547
4. Suga, H., Chen, Z., de Mendoza, A. et al. (2013). The Capsaspora genome reveals a complex unicellular prehistory of animals. Nature Communications 4, 2325
5. Tong K., Wang Y. & Su Z. (2017). Phosphotyrosine signalling and the origin of animal multicellularity. Proceedings of the Royal Society B 284, 20170681.
6. Ruiz-Trillo I. (2016). What are the genomes of premetazoan lineages telling us about the origin of Metazoa. Multicellularity origins and evolution. Vienna series in theoretical biology. The MIT Press, Cambridge, MA, 171-184
Новость представила ©Агния Соколова
08.08.2022