 © Паюшина Ольга Викторовна
старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
© Паюшина Ольга Викторовна
старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
Реконструкция in vitro процесса эмбрионального кроветворения у человека представляет собой как теоретически, так и практически важную задачу. С одной стороны, этические и технические проблемы работы с человеческим эмбриональным материалом порождают необходимость создания экспериментальных моделей для изучения начальных стадий развития кроветворной системы в условиях клеточной культуры, с другой – получение in vitro стволовых кроветворных клеток (СКК) могло бы удовлетворить потребности пациентов, нуждающихся в их трансплантации. Перспективным подходом к решению этой задачи является дифференцировка плюрипотентных клеток человека (в частности, эмбриональных стволовых) в кроветворном направлении.
Способность эмбриональных стволовых клеток дифференцироваться через стадию гемангиобласта в эндотелиальные и кроветворные предшественники известна с конца 90-ых годов (Choi K., Kennedy M., Kazarov A., Papadimitriou J.C., Keller G. A common precursor for hematopoietic and endothelial cells. Development. 1998; 125(4): 725-732), но до сих пор таким образом удавалось получать лишь короткоживущую транзиторную популяцию кроветворных клеток, подобную той, что в эмбриогенезе млекопитающих образуется в желточном мешке. Однако, по современным представлениям, основным (а возможно, и единственным) источником дефинитивных СКК, обеспечивающих поддержание гемопоэза в течение всей жизни организма, является не желточный мешок, а аорто-гонадо-мезонефральная область (АГМ), точнее – гемогенный эндотелий дорзальной аорты. Авторы статьи, опубликованной в 2016 г. в журнале «Nature Biotechnology» (Ng E.S., Azzola L., Bruveris F.F. et al. “Differentiation of human embryonic stem cells to HOXA+ hemogenic vasculature that resembles the aorto-gonad-mesonephros”, Nature Biotechnology. 2016. doi: 10.1038/nbt.3702), изменив условия дифференцировки эмбриональных стволовых клеток человека, впервые сумели добиться образования в эмбриоидных телах сосудистых структур, экспрессирующих маркеры гемогенного эндотелия аорты и дающих начало кроветворным клеткам, воссоздав тем самым основные аспекты гемопоэза в АГМ.
В их работе для идентификации кроветворных клеток был использован фактор транскрипции RUNX1C, экспрессируемый происходящими из АГМ СКК. В первоначальных экспериментах, предполагавших культивирование эмбриональных стволовых клеток в стандартной бессывороточной среде, он маркировал субпопуляцию CD34+ клеток, обогащенную клоногенными кроветворными предшественниками. После внутривенного введения облученным иммунодефицитным мышам эти клетки мигрировали в костный мозг, однако, в отличие от образующихся in vivo дефинитивных СКК, не обладали способностью к длительному приживлению в нем. Сравнивая их с CD34+ клетками из пуповинной крови человека, которые такую способность имеют, авторы обнаружили различия в экспрессии гомеобоксных генов HOXA: в кроветворных клетках, полученных из эмбриональных стволовых, эти гены были неактивны. Путем активации сигнального пути Wnt и одновременного ингибирования сигнального пути активина авторы индуцировали экспрессию HOXA в формирующейся из эмбриональных стволовых клеток мезодерме, что привело к подавлению в эмбриоидных телах примитивного гемопоэза, свойственного желточному мешку, и образованию эндотелиальных клеток, по транскрипционному профилю подобных эндотелию аорты. Как и в нативном АГМ, часть эндотелиоцитов экспрессировали SOX17 – фактор транскрипции, маркирующий гемогенный эндотелий и необходимый для образования из него СКК.
Начиная с 9-10-го дня дифференцировки SOX17+ эндотелиальные клетки формировали в эмбриоидных телах разветвленную сеть сосудов, а с 15-го дня внутри этих сосудов появлялись кроветворные клетки, экспрессирующие ген RUNX1C. Некоторые из них сочетали экспрессию обоих маркеров – эндотелиального SOX17 и кроветворного RUNX1C; вероятно, они представляли собой промежуточную стадию перехода от эндотелия (SOX17+ RUNX1C-) к более зрелым кроветворным клеткам с фенотипом SOX17- RUNX1C+. После 14-18 дней дифференцировки в культуре обнаруживались клоногенные клетки, способные к образованию миелоидных колоний; позднее появлялись предшественники эритроидных и смешанных колоний, причем в эритроидных клетках происходило переключение экспрессии генов глобина с эмбриональных на свойственные взрослому организму.
Следует отметить, что такая картина, сходная с образованием гемогенного эндотелия и кроветворных клеток в АГМ, наблюдалась лишь в том случае, если в эмбриоидных телах была индуцирована экспрессия HOXA. В контрольных культурах, не подвергнутых модуляции сигнальных путей Wnt и активина, дифференцировка носила иной характер: уже на 9-10 день появлялись многочисленные кроветворные клетки, несущие маркер CD43, однако сосуды, состоящие из SOX17+ клеток, не образовывались. Через 3-4 недели численность кроветворных клеток в контрольных культурах была меньшей по сравнению с обработанными агонистом сигнального пути Wnt и ингибитором сигнального пути активина; через 30 дней клоногенные предшественники в них уже не обнаруживались. По профилю экспрессии генов эндотелиальные и кроветворные клетки, образовавшиеся в эмбриоидных телах, были очень сходны с соответствующими популяциями, выделенными из АГМ человеческого зародыша. Однако эти кроветворные клетки не обладали важнейшей функциональной характеристикой дефинитивных СКК - способностью длительно приживаться в костном мозге облученной мыши. Впрочем, судя по данным предыдущих исследований, в АГМ как мыши, так и человека такая способность присуща лишь единичным клеткам; большинство же находятся на стадии предшественников, приобретающих свойства длительно репопулирующих СКК уже после миграции в печень зародыша. Не исключено, что и АГМ-подобные клетки, полученные в данной работе, представляли собой пре-СКК, требующие дополнительной стадии созревания. Как известно, кроветворные предшественники из АГМ мыши могут проходить эту стадию in vitro: сокультивирование со стромальной линией OP9 делает их способными репопулировать костный мозг реципиента. Можно предположить, что аналогичный подход позволит получать функционально полноценные СКК и из клеток человека.
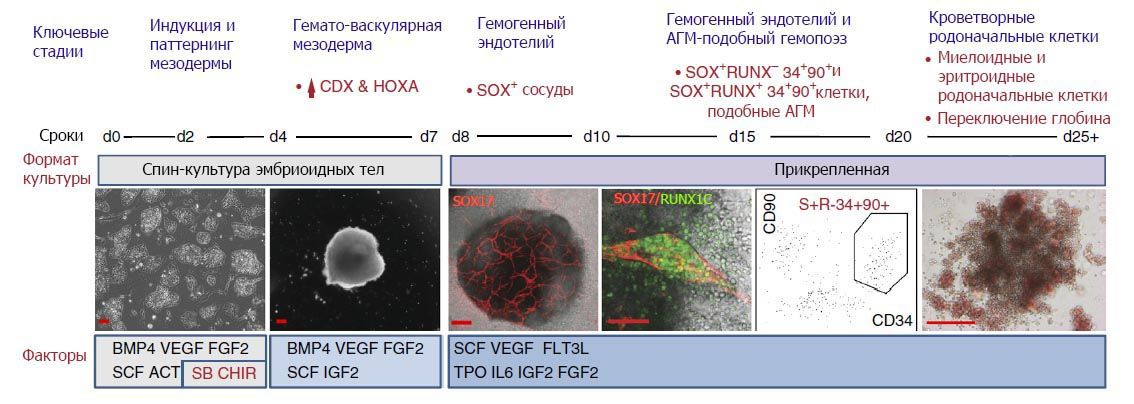 |
Получение АГМ-подобных стволовых/родоначальных клеток из эмбриональных стволовых клеток человека: стадии развития и условия культивирования. CHIR - агонист сигнального пути Wnt CHIR99021; SB - антагонист сигнального пути активина SB431542.
Новость подготовила © 2016 Паюшина О.В.
07.11.2016