Комментарий к статьям:
Girskis K.M., Stergachis A.B., DeGennaro E.M., Doan R.N., Qian X., et al. Rewiring of human neurodevelopmental gene regulatory programs by human accelerated regions // Neuron. 2021. S0896-6273(21)00580-8. doi: 10.1016/j.neuron.2021.08.005
Fiddes I.T., Lodewijk G.A., Mooring M., Bosworth C.M., Ewing A.D., et al., Human-specific notch2nl genes affect notch signaling and cortical neurogenesis // Cell. 2018. V.173. No. 6. P. 1356-1369.e22. doi: 10.1016/j.cell.2018.03.051.
Shibata M., Pattabiraman K., Lorente-Galdos B. et al. Regulation of prefrontal patterning and connectivity by retinoic acid // Nature. 2021. doi.org/10.1038/s41586-021-03953-x
Shibata M. et al. Hominini-specific regulation of CBLN2 increases prefrontal spinogenesis. Nature. 2021. doi.org/10.1038/s41586-021-03952-y
 © Дьяконова Варвара Евгеньевна, доктор биологических наук, профессор РАН. Главный научный сотрудник лаборатории нейробиологии развития.
© Дьяконова Варвара Евгеньевна, доктор биологических наук, профессор РАН. Главный научный сотрудник лаборатории нейробиологии развития.
Область научных интересов: нейроэтология, нейробиология, нейротрансмиттеры, поведение.
Вопрос, давно интересовавший не только эволюционных нейробиологов, но гораздо более широкие слои человеческой популяции: что делает мозг человека человеческим, отличным от других позвоночных. Сравнительная геномика и транскриптомика последних лет (2018-2021) позволили совершить значительные открытия в этой области. Начнем с того, что поиск регуляторных функций участков генома, специфичных для человека и обладающих высокой скоростью эволюции, показал, что подавляющее большинство из них регулирует развитие нервной системы (Girskis et al., 2021). Эти данные позволяют сделать вывод: именно изменения в нервной системе сделали человека человеком. Очевидно, что понимание конкретной роли разных отделов генома, связанных с регуляцией развития нервной системы, придет намного позже. Пока удалось выяснить, каким образом в онтогенезе у человека число нейронов коры головного мозга увеличивается по сравнению с мозгом других позвоночных, почему может замедляться клеточный цикл нейрональных предшественников у приматов и особенно у человека, и какие факторы определяют отличия в формировании области головного мозга человека с наиболее быстрым эволюционным развитием: префронтальной коры.
Показано, что одним из механизмов увеличения числа нейронов оказывается замедление перехода нейрональных прогениторных клеток к дифференцировке, позволяющее им совершать дополнительные циклы митоза (Fiddles et al., 2018). Увеличение площади коры головного мозга современного человека могло быть обеспечено частичной дупликацией гена notch2, существующего у других приматов. Эта древняя неполная дупликация с изменением последовательности гена привела к появлению гена notch2nl, продукт которого влияет на развитие нейрональных прогениторных клеток коры. Этот ген претерпел еще две дупликации, и современный человек в результате имеет три копии этого гена. Повышение экспрессии notch2nl ведет к замедлению дифференцировки прогениторных клеток в нейроны и увеличению их числа, а как следствие – к увеличению числа нейронов, как показано в экспериментах на культуре клеток и мозговых органоидах (Fiddles et al., 2018). Интересно, что эта область генома отличается нестабильностью и у современных людей - встречаются геномы с числом копий notch2nl две и четыре. В первом случае развивается микроцефалия, во втором – макроцефалия (Fiddles et al., 2018).
Недавним открытием стала также демонстрация экспрессии серотонинового рецептора HTR2A базальными предшественниками нейронов радиальной глии у человека как одного из факторов замедления дифференцировки базальных предшественников и увеличения числа нейронов (Xing et al., 2020). Экспрессия HTR2A характерна и для некоторых других позвоночных, обладающих выраженной складчатостью коры, но отсутствует у видов с более гладкой корой (что отражает меньшее число нейронов и меньшую площадь коры). Экспрессия этого рецептора определяет зависимость числа нейронов от концентрации серотонина в онтогенезе, и участвует в механизме формирования контекст-зависимых индивидуальных различий (см. подробный комментарий М. Межерицкого на сайте ИБР РАН).
Ну и наконец, самым громким последним событием в этой области, можно считать две статьи, вышедшие в октябре в Nature (Shibata et al., 2021 a,b). Они сообщили об участии ретиноевой кислоты (производного витамина А) в специфическом нейрогенезе префронтальной коры (ПФК) у человека. Авторы занимались поиском механизмов, отвечающих за эволюционное расширение ПФК и ее связей с медио-дорсальным таламусом у приматов и человека. Считается, что ПФК отвечает за познавательную деятельность, когнитивную пластичность, самоконтроль, рабочую память, социальные взаимодействия. Именно эта область мозга характеризуется наиболее быстром эволюционным развитием у высших позвоночных. Ее морфологическими маркерами у примат является латеральное расширение и увеличение четвертого зернистого (гранулярного) слоя. Онтогенетические механизмы, определяющие эти особенности оставались до последнего времени неизвестными.
Используя данные секвенирования РНК BrainSpan человека (RNA-seq), авторы провели скрининг генов, которые дифференциально активируются в средней части лобной доли плода на 16 – 22 неделе после зачатия. Исследованные области включали четыре предполагаемых области ПФК (медиальная, орбитальная, дорсолатеральная, вентролатеральная) и первичную моторную кору. Экспрессия генов в этих лобных областях сравнивалась с областями теменной (первичная сенсорная кора, S1C; нижняя теменная кора, IPC), затылочной (первичная зрительная кора, V1C) и височных долей (первичная слуховая кора, A1C). Анализ дифференциальной активации генов во фронтальных областях с использованием технологии генной онтологии (GO) выявил следующие категории генов: «чувствительные к ретиноевой кислоте», «связанные с образованием синапсов» и «отвечающие за развитие аксонов».
Используя иммуноферментный анализ (ELISA), авторы оценили концентрацию ретиноевой кислоты в развивающемся мозге человека, макаки и мыши. В мозге человека обнаружен выраженный градиент концентрации в передне-заднем направлении с максимальными значениями в лобных отделах (Рис. 1). Различия в концентрации ретиноевой кислоты в разных областях присутствуют и в мозге макаки, но градиент, по сравнению с человеком, сглажен, и наименее выражен он у мыши. Экспрессия ферментов синтеза ретиноевой кислоты была также выше в лобных отделах, и значимо отличалась у приматов (человек и макака) от уровня экспрессии в лобных отделах грызунов (мышей).
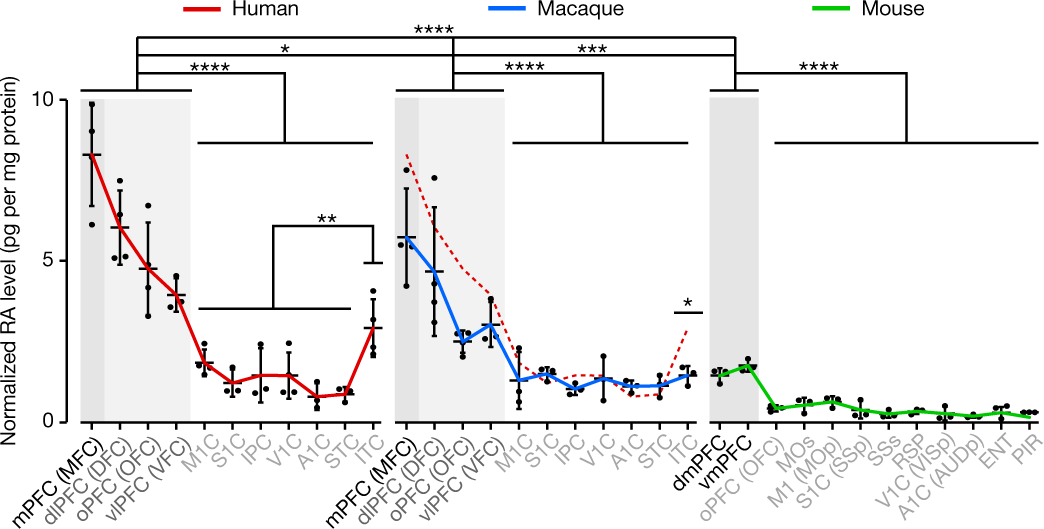
Концентрация ретиноевой кислоты регулируется также ферментом CYP26B1, катаболизирующим ретиноевую кислоту и тем самым ограничивающим ее влияние. Экспрессия этого фермента выше в каудальных областях по сравнению с префронтальными, что также может способствовать формированию передне-заднего градиента ретиноевой кислоты. Лактозо-зависимое нокаутирование этого гена в перинатальной лобной коре у мышей привело к росту концентрации ретиноевой кислоты, умеренному увеличению передних отделов, а также к повышенной экспрессии гена Rorb, характерного для четвертого гранулярного слоя ПФК антропоидных приматов, и расширению медиальной таламокортикальной иннервации.
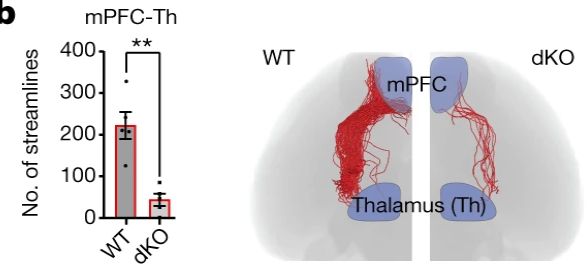
Генетические делеции у мышей показали, что передача сигналов ретиноевой кислоты через рецепторы RXRG и RARB отвечает за формирование правильного паттерна экспрессии и развития префронтальной и моторной областей, а также связей между ПФК и медиодорсальным таламусом (Рис. 2).
Интересно, что градиент концентрации ретиноевой кислоты сходен с градиентом плотности дендритных шипиков, которая также уменьшается в передне-заднем направлении, что особенно выражено в префронтальной коре человека по сравнению с другими млекопитающими. Сравнив транскриптомные данные человека и макаки во время развития, совпадающего с началом синаптогенеза в коре, авторы обнаружили достоверное увеличение церебеллина 2 (CBLN2), нейрексина (NRXN) и белка-синаптического организатора, связанного с GRID / GluD-рецептором глутамата у человека. Видовые различия в уровне экспрессии и распределении в коре церебеллина, по крайней мере частично, оказались обусловленными делециями, содержащими сайты связывания SOX5 в энхансере CBLN2, реагирующем на ретиноевую кислоту, которые специфичны для рода Homini. “Генетическая гуманизация” in situ энхансера мышиного Cbln2 (то есть замена его на человеческий) вызывает повышенную экспрессию Cbln2 и способствует образованию дендритных шипиков в ПФК.
Таким образом, впервые было показано, что усиление сигнальной роли ретиноевой кислоты играет критическую роль в развитии ПФК и ее расширении в эволюции позвоночных. При этом оказалось, что не только увеличение концентрации ретиноевой кислоты, но и повышение чувствительности к ней энхансера церебеллина, определяют выраженный передне - задний градиент плотности дендритных шипиков и другие особенности развития ПФК человека.
Новость подготовила © Дьяконова В.Е.
07.10.2021