Изучение раннего эмбриогенеза человека важно как в практическом, так и в фундаментальном смыслах. Несмотря на это, изучение данной области значительно затруднено в связи с невозможностью наблюдать развитие постимплантационного эмбриона in situ и этическими ограничениями, сопряженными с поддержанием развивающегося эмбриона в культуре in vitro. В последние несколько лет активно развивается направление воссоздания различных процессов раннего эмбриогенеза с использованием клеточных конструктов из плюрипотентных клеток. Такие конструкты обладают способностью к некоторой степени самоорганизации и воспроизведению некоторых паттернов развития настоящего эмбриона. Кроме того, работа с такими моделями не сопряжена с какими-либо этическими вопросами.
В работе, освещенной в этой заметке, было показано создание в микрофлюидной системе эмбриоподобного конструкта из плюрипотентных клеток человека. При дальнейшем культивировании на модели были показаны процессы, схожие с дифференцировкой эпибласта и амниотической эктодермы, развитием биполярного эмбрионального мешка, образованием проамниотической полости и выделением популяций эмбриональных половых клеток и клеток первичной полоски. Также, было показано, что в рамках данной модели аналог амниотической эктодермы является центром химической индукции и участвует в запуске процессов, схожих с гаструляцией.
Для создания эмбриоидов в работе использовалась культуральная микрофлюидная система, состоящая из трех каналов. В одном из каналов находился комплексный препарат внеклеточного матрикса Geltrex, который со временем сжимался, что вызывало образования карманов в стенках каналов. Во второй канал загружались клетки, а в третий – различные биоактивные молекулы. Сначала в канал для клеток поступала суспензия клеток, они оседали в карманах на стенках канала, где со временем образовывали кластеры.
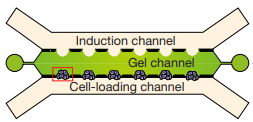
Была показана способность кластера клеток к люменогенезу. При добавлении в среду FGF2 в скоплении клеток образовывалась полость, окруженная Oct4+/Sox2+/Nanog+ клетками, схожими с клетками эпибласта. Когда в ходе эксперимента в среду был добавлен BMP4, полученная циста поляризовалась. Клетки на одном ее полюсе, обращенном к воздействию, стали напоминать уплощенные клетки амниотической эктодермы, тогда как клетки на другом полюсе больше походили на эпителий эпибласта. Данные популяции клеток были названы: Amniotic Ectoderm Like Cells (AMLCs) и Epiblast Like Cells (EPILCs).
Популяции клеток были охарактеризованы по экспрессии специфических маркеров, что подтвердило их сходство с клетками амниотической эктодермы и эпибласта. Клетки AMLC имели фенотип TFAP2A+/CDX2+, также была показана ядерная локализация pSMAD1/5 (участника сигнального пути BMP). Клетки EPILC были CDX2+/Brachyury+ и теряли экспрессию Nanog со временем, что соответствует смене фенотипа плюрипотентности на фенотип, предшествующий образованию первичной полоски. Таким образом, изначально не поляризованная циста, состоящая из эпибластоподобных клеток, демонстрирует черты происходящей у нормального эмбриона дорзо-вентральной поляризации. Полученная структура была названа: Polarized Embryonic Like Sac (P-ELS).
Как было показано в других исследованиях, выделение первичных половых клеток происходит у приматов (Macaca fаscikularis) в период, предшествующий гаструляции. Поэтому было решено проверить, происходит ли подобное в сгенерированном суррогате эмбриона. В P-ELS была обнаружена популяция TFAP2С+/Sox17+ клеток, которые были определены, как аналог ранних первичных половых клеток. После тридцати шести часов культивирования эта популяция была локализована в месте соединения популяций AMLC и EPILC клеток, что соответствует локализации этой популяции в норме у человека.
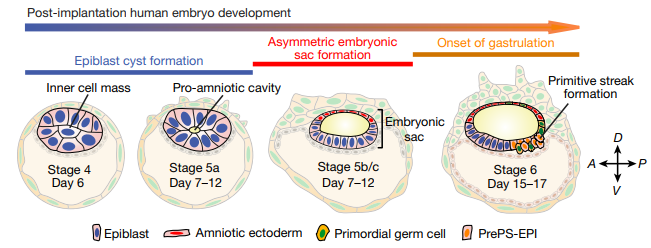
Далее было изучено выделение в P-ELS популяции клеток, напоминающей первичную полоску. Для этого сравнивали эффект от добавления в среду четырех наборов агентов: Wnt3a; ActivinA; Wnt3a/BMP4 и ActivinA/BMP4. В первом случае образовывались полые структуры из клеток EPILC. При добавлении ActivinA образовывались цисты, состоящие из смеси клеток EPILC и клеток, напоминающих по фенотипу клетки переднего края первичной полоски: Eomes+/Brachyury+/Cdx2-. При введении в среду Wnt3a/BMP4 получались нормальные P-ELS. В последнем же случае образовывались поляризованные полые клеточные структуры. Со стороны воздействия они состояли из AMLC клеток, а на противоположном полюсе находились также Eomes+/Brachyury+/Cdx2- клетки. Полученные результаты указывают на то, что ActivinA вызывает формирование фенотипа клеток переднего края первичной полоски.
Далее авторы искали ответ на вопрос, происходят ли в P-ELS события, аналогичные гаструляции. Через 36 часов после начала культивирования на полюсе, сходном с эпибластом, образовывалось утолщение, единичные клетки приобретали мезенхимный фенотип и начинали мигрировать. К сорока восьми часам культивирования мигрирующие клетки разделяются на лидирующие (Brachyury+/Eomes+/N-cadherin+/Cdx2-) и отстающие (Brachyury+-/Eomes-/N-cadherin-/Cdx2+). При добавлении ActivinA выделяются клетки с наиболее миграторным фенотипом и экспрессией: Eomes++/N-cadherin++. У мышей гаструляция запускается сигналами, поступающими от экстраэмбриональной эктодермы. Однако, аналог экстраэмбриональной эктодермы у человека отделен от эпибласта амниотической эктодермой. В связи с этим авторы работы решили изучить роль сигналов амниотической эктодермы для начала гаструляции. Для этого эмбриональные стволовые клетки человека сокультивировали с клетками AMLC. В результате клетки приобретали фенотип клеток заднего края первичной полоски. Для дальнейшего изучения были сгенерированы P-ELS, состоящие из GFP линии стволовых клеток, отображающих наличие Wnt-β-catenin сигналинга. Было показано, что выделение зоны первичной полоски подавляется IWP2, но не IWR1 (ингибитор оборота AXIN2). Таким образом, в рамках данной модели начало гаструляции не зависит от AXIN2, что подтверждается данными, полученными методами FISH и РНК секвенирования одиночных клеток. Возможность наблюдения на этой модели множества ключевых событий раннего эмбриогенеза, особенно процессов, сходных с нормальной гаструляцией, говорит о большой способности эмбриоидов к самоорганизации. В последнее время быстро растет число работ, посвященных моделированию раннего эмбриогенеза млекопитающих при помощи клеточных конструктов, состоящих из различных линий плюрипотентных клеток. На данный момент можно говорить об использовании этого метода, как о тренде в современной эмбриологии.
Новость подготовила © Измайлова Л.Ш.
07.10.2019
 ©
©