https://doi.org/10.1038/s41536-025-00411-4

Область научных интересов: эпителио-мезенхимные взаимодействия в легких млекопитающих, стромальные клетки легких и их роль в морфогенезе, клеточные механизмы регенерации в легочной ткани.

Область научных интересов: мезенхимальные клетки легкого, легочные органоиды, клеточная дифференцировка.
Эпителий дыхательных путей разнообразен и глобально подразделяется на клетки проксимальных и дистальных участков. К эпителиальным клеткам верхних дыхательных путей относятся реснитчатые, бокаловидные, клетки Клара и другие типы клеток бронхиол. В альвеолах основной эпителий составляют альвеолоциты 1 и 2 типов (АТ1 и АТ2). При этом в альвеолярном эпителии роль взрослых стволовых клеток, участвующих в регенерации ткани после повреждения, выполняют АТ2 клетки, а в бронхиолярном - базальные стволовые эпителиальные клетки. Изучение механизмов, позволяющих активировать процессы дифференцировки различных клеток при регенерации в легких, является одной из основных задач регенеративной медицины.
В рамках развития современных подходов клеточной терапии альвеолярных участков легких активно исследуется вопрос культивирования, поддержания функциональности и трансплантации АТ2 клеток. Трансплантируемые АТ2 клетки должны обеспечивать поддержание гомеостаза в эпителиальной ткани и обладать хорошей приживаемостью, пролиферативной активностью, способностью к самообновлению и дифференциации. При этом, свежевыделенные АТ2 клетки трудно культивируемы, а получение альвеолярного эпителия из человеческих эмбриональных стволовых клеток практически недоступно в силу этических соображений. Перспективным решением проблемы получения пульмонарных эпителиальных клеток, подходящих для трансплантации в легкие, является прямое репрограммирование фибробластов легких в АТ2 клетки, предложенное в работе Morita A. и др., 2025. При этом авторами разработан уникальный протокол контролируемой дифференцировки фибробластов в индуцированные пульмонарные альвеолярные клетки легких (iPULs) посредством оверэкспрессии нескольких транскрипционных факторов.
В работе авторы для трансдукции фибробластов провели скрининг факторов транскрипции, связанных с дифференцировкой альвеолоцитов, и выявили, что максимальную индукцию экспрессии Sftpc, маркера АТ2 клеток, вызывает комбинация четырех генов: Nkx2-1, Foxa1, Foxa2 и Gata6.
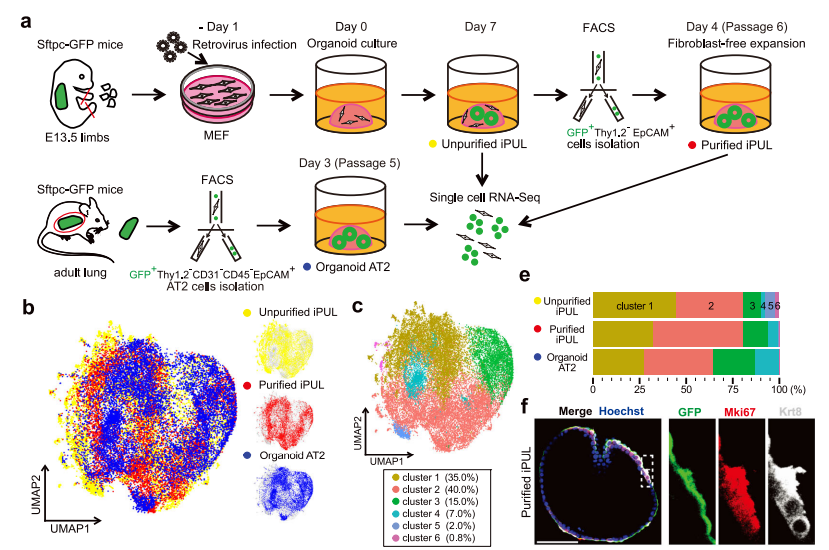
Для отслеживания дифференцировки были использованы эмбриональные фибробласты мыши (MEF), выделенные из мышей с репортером Sftpc-GFP. MEF, индуцированные четырьмя факторами транскрипции (TF), культивировали в органоидной модели с последующей сортировкой Sftpc-GFP+, Thy1.2– (отсутствие мезенхимального маркера) и EpCAM+ (эпителиальный маркер) клеток с помощью флуоресцентно-активируемого сортинга (FACS). При этом, доля Sftpc-GFP+ Thy1.2– EpCAM+ клеток увеличивалась со временем культивирования. Клетки Sftpc-GFP+ Thy1.2– EpCAM+ характеризовали как успешно репрограммированные, способные после повторного культивирования образовать органоиды, подобные органоидам, полученным с помощью АТ2 клеток.
Для верификации полученные индуцированные пульмонарные клетки легких – iPULs – сравнивали с несколькими типами клеток мыши: АТ2 – первичными и культивированными в составе органоидов, MEF, а также клетками эпителия эмбрионального и взрослого легкого. С помощью электронной микроскопии оценили морфологию – выявили ламеллярные тельца и микроворсинки, характерные для АТ2-клеток. Кроме того, использовали методы РНК-секвенирования (bulk RNA-seq и single cell RNA-seq) и иммунофлуоресцентного окрашивания, которые показали, что по молекулярному профилю, а также по экспрессии ключевых белков iPULs близки как к органоидным, так и первичным АТ2-клеткам.
а. Дизайн эксперимента scRNA-sec неочищенных и очищенных iPULs в сравнении с органоидами из АТ2 клеток. Кластеризация транскриптомов с использованием графиком UMAP на основе происхождения клеток (b). и алгоритма Лувена (с). e. Разбивка кластеризованных клеток на образец. f. Люминесценция Sftpc-GFP (зеленый), иммунофлуоресцентное окрашивания Mki67 (маркер пролиферации, красный) и krt8 (маркер транзиторных клеток, серый). Фрагмент из иллюстрации. https://doi.org/10.1038/s41536-025-00411-4, article is available under the Creative Commons CC-BY-NC-ND license
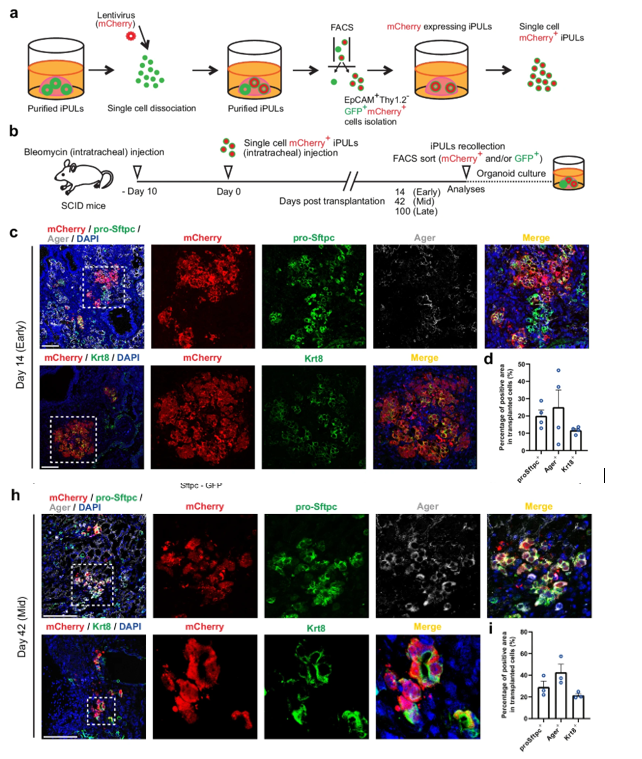
Для проверки функциональности полученные iPULs трансплантировали в легкие иммунодефицитных мышей с экспериментальным блеомицин-индуцированным фиброзом легких. После введения iPULs успешно интегрировались в альвеолярный эпителий, формируя клетки, похожие на АТ2 и АТ1. При этом, трансплантированные клетки сохранялись в клетках до 100 дней и не вызывали опухолевого роста.
a. Дизайн эксперимента производства iPUL, экспрессирующих mCherry. b. Дизайн эксперимента трансплантации. h. Иммунофлуоресцентное окрашивание легочной ткани через 42 дня после трансплантации, mCherry (красный), pro-Sftpc (зеленый), Ager (серый) на верхней панели и mCherry (красный), krt8 (зеленый) на нижней панели. i. Процент положительных областей для каждого клеточного маркера в mCherry-положительных iPUL через 42 дня после трансплантации. Иллюстрация из статьи https://doi.org/10.1038/s41536-025-00411-4, article is available under the Creative Commons CC-BY-NC-ND license
Таким образом, фибробласты мыши могут быть эффективно репрограммированны в АТ2-подобные клетки легких. Более того, полученные эпителиальные клетки могут быть успешно культивируемы в составе органоидов, демонстрируют способность к пролиферации и обладают регенеративным потенциалом. Разработанная авторами статьи технология репрограммирования фибробластов в эпителиоподобные клетки имеет высокий потенциал для использования в трансплантационной медицине.
Новость подготовили
Говорова Ирина Александровна, старший научный сотрудник лаборатории нейробиологии развития ИБР РАН, кандидат биологических наук.
Новикова Юлия Андреевна, старший лаборант лаб. клеточной биологии, аспирант
07.07.2025