 © Сухопутова Алëна Валентиновна, младший научный сотрудник лаборатории эволюции морфогенезов ИБР РАН. Кандидат биологических наук.
© Сухопутова Алëна Валентиновна, младший научный сотрудник лаборатории эволюции морфогенезов ИБР РАН. Кандидат биологических наук.
Область научных интересов: эволюционная биология развития, жизненный циклы беспозвоночных, Cnidaria.
Ферменты, регулирующие упаковку хроматина, были вовлечены в дифференцировку клеток ещё до расхождения филогенетических линий Cnidaria и Bilateria
Во время развития многоклеточного организма плюрипотентные клетки дифференцируются, приобретая специфические черты, характерные для клеток определённых типов. Дифференцировка клеток во многом обеспечивается эпигенетическими механизмами: активностью транскрипционных факторов, метилированием ДНК, модификациями гистонов и др. В последнее время внимание исследователей всё больше привлекают модификации гистонов, за счет которых меняется упаковка хроматина. Существует система регуляции активности и самих ферментов, модифицирующих гистоны, – на уровне транскрипции, сплайсинга и т.д. Модификации гистонов вовлечены в регуляцию транскрипции как у многоклеточных организмов, так и у одноклеточных эукариот. Однако остаётся неясным, на каком этапе эволюции модификации гистонов стали участвовать в регуляции индивидуального развития клеток разных типов. Для того чтобы это понять, необходимо выяснить, какие группы Eumetazoa задействуют модификации гистонов в процессе дифференцировки клеток.
Данный вопрос изучен в первую очередь на представителях Bilateria. Например, фермент лизин-специфическая деметилаза 1 (Lsd1 или KDM1A) участвует в отделении моно- или диметильной группы лизина 4 на N-концевом фрагменте корового гистона H3, что подавляет транскрипцию целевого гена (Lee et al., 2005; рис. 1). На мышах было показано, что колебания концентраций Lsd1 важны для нейрогенеза, а полная потеря фермента летальна (Wang et al., 2007; Popova et al., 2016). Со встречающимися у людей мутациями Lsd1 связывают серьёзные когнитивные нарушения (Tunovic et al., 2014). Потеря гена деметилазы у изученных беспозвоночных приводит к развитию ряда аномалий, в том числе выраженным дефектам строения женской половой системы у Drosophila melanogaster и нарушению дифференцировки клеток половой линии у Caenorhabditis elegans (Stefano et al., 2007; Katz et al., 2009).
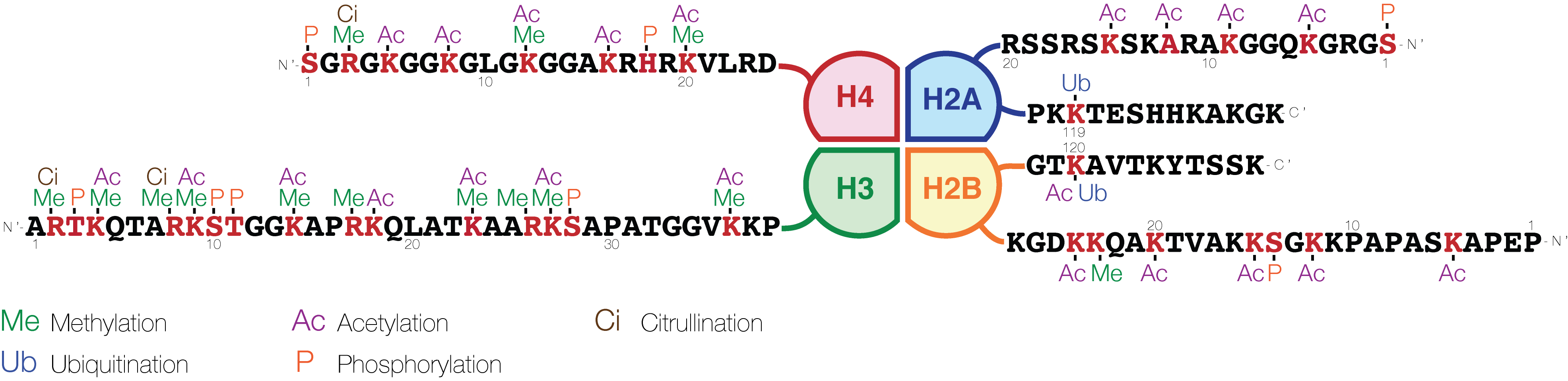 Рис. 1.
Схематическое изображение модификаций коровых гистонов. Иллюстрация из Wikipedia.
Рис. 1.
Схематическое изображение модификаций коровых гистонов. Иллюстрация из Wikipedia.
Тип Cnidaria относится к базальным Metazoa. Эта группа является сестринской по отношению к Bilateria. Известно, что у представителей Cnidaria имеются ферменты, сходные с теми, что участвуют в модификации гистонов у изученных Bilateria. Однако их роль в дифференцировке клеток пока не была показана. В частности, шестилучевой коралл, актиния Nematostella vectensis обладает гомологом Lsd1–NvLsd1. Эмбриональное развитие Nematostella проходит через стадии бластулы и инвагинационной гаструлы. В результате гаструляции образуется два зародышевых листка, эктодерма и эндодерма. На более поздних стадиях формируется свободноплавающая личинка – планула, а затем - полип. Нервная система полипа представлена несколькими популяциями сенсорных клеток и би- / мультиполярными нейронами. Для представителей Cnidaria характерны стрекательные клетки (книдоциты), обладающие стрекательной капсулой (книдоцистой). Этот уникальный для книдарий тип клеток рассматривается как "визитная карточка" и эволюционное новшество таксона. Книдоциты используются для питания и защиты, они способны в ответ на раздражение выстреливать нить, опутывающую и нередко пронзающую добычу или обидчика.
В исследовании, опубликованном в январе этого года, учёные из Sars International Centre for Marine Molecular Biology (Берген, Норвегия) продемонстрировали, что NvLsd1 экспрессируется во всех клетках гаструлы, планулы и полипа N. vectensis (Gahan et al., 2022). Интересно, что начиная со стадии ранней гаструлы равномерность экспрессии NvLsd1 теряется. В некоторых, отдельно расположенных клетках эктодермы уровень экспрессии NvLsd1 заметно выше, чем в других (рис. 2 j-l). Различия между эктодермальными клетками с низким и высоким уровнем экспрессии NvLsd1 становятся более явными по мере развития (рис. 2 i-l). Кроме того, на стадиях поздней гаструлы и планулы экспрессия этого гена повышается также во всех клетках эндодермы (рис. 2 d, e). После метаморфоза особенно интенсивная экспрессия наблюдается в глотке и щупальцах полипа (рис. 2 f).
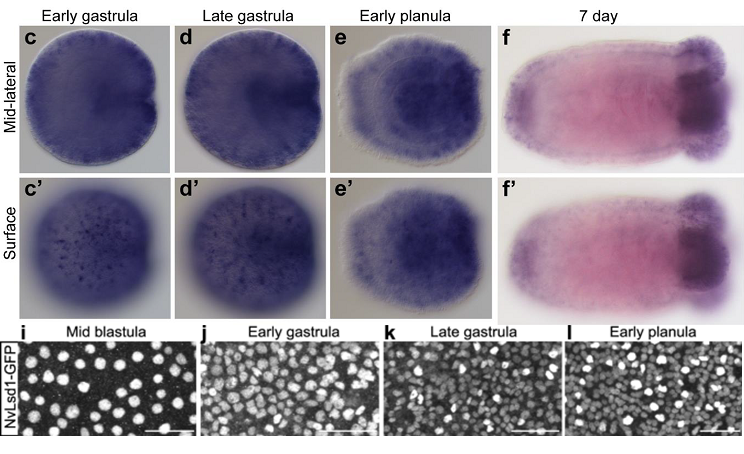 Рис. 2.
Экспрессия NvLsd1 на разных стадиях развития Nematostella vectensis (подписи стадий даны сверху). c-f – данные гибридизации in situ с пробой к NvLsd1. i-l – эктодерма животных трансгенной линии NvLsd1GFP, мо 20 мкм. Иллюстрации из обсуждаемой статьи
Gahan et al., 2022 и дополнительных материалов к ней.
Рис. 2.
Экспрессия NvLsd1 на разных стадиях развития Nematostella vectensis (подписи стадий даны сверху). c-f – данные гибридизации in situ с пробой к NvLsd1. i-l – эктодерма животных трансгенной линии NvLsd1GFP, мо 20 мкм. Иллюстрации из обсуждаемой статьи
Gahan et al., 2022 и дополнительных материалов к ней.
Исследователи сравнили локализацию меткиEdU (синтез ДНК) и экспрессию белка GFP у животных трансгенной линии NvLsd1GFP, у которых белок GFP коэкспрессировался с деметилазой NvLsd1. Оказалось, что среди клеток, находящихся в S, G2 и G1 фазах, не встречаются клетки с повышенным содержанием белка NvLsd1 в ядрах. Более высокое содержание белка NvLsd1 было характерно для уже дифференцированных сенсорных клеток, нейронов и книдоцитов. Это было показано с помощью линий животных, у которых за счёт трансгенеза были визуализированы определенные типы клеток: у линии NvFoxQ2d::mOrange – одна из популяций сенсорных клеток; у линии NvElav1::mOrange – сенсорные клетки другой популяции и би- / мультиполярные нейроны; у линии NvNcol3::mOrange2 – капсулы книдоцитов; наконец, у линии NvPTx1::mOrange2 – одна из популяций эктодермальных железистых клеток.
С помощью технологии CRISP-Cas9 авторы получили линию животных, у которых белок NvLsd1 не способен к своей обычной каталитической активности (аллель NvLsd1-). Смертность таких животных до стадии полипа не отличалась от смертности в контроле. Однако на ранних стадиях развития в клетках эмбриона линии NvLsd1-/- всё ещё сохраняется каталитически активный белок, унаследованный от материнского организма.
Анализ дифференциальной экспрессии генов показал различия в экспрессии 1641 генов на стадии поздней планулы и 7080 генов на стадии первичного полипа для животных с нефункциональным белком NvLsd1 по сравнению с контролем. На стадиях планулы и первичного полипа 67% и 31% отличий, соответственно, относятся к генам, активно экспрессирующимся в книдоцитах. И всего 12% и 13% отличий - к генам, активно экспрессируюшимся в сенсорных клетках и би- / мультиполярных нейронах. При этом транскрипционные факторы NvPaxA и NvPOU4 экспрессируются у мутантных животных без изменений, а транскрипция Cnido-Jun и Cnido-Fos1 снижена. Эти транскрипционные факторы необходимы для дифференцировки книдоцитов (Sunagaretal., 2018). Таким образом, NvLsd1 включается в дифференцировку книдоцитов раньше, чем Cnido-Jun и Cnido-Fos1, но позже, чем NvPaxA и NvPOU4.
Мини-коллаген NvNcol3 содержится в стенках зреющих книдоцист, и антитела к нему позволяют визуализировать недоразвитые стрекательные клетки. Мечение с помощью DAPI помогает визуализировать матрикс полностью дифференцировавшихся стрекательных клеток. Благодаря совмещению этих методов, исследователям удалось узнать, что на стадии поздней планулы и полипа у мутантных животных значительно снижено число зрелых книдоцитов (рис. 3 f, g). При этом имеющиеся у них книдоцисты отличаются от книдоцист контрольных животных. У NvLsd1-/- планул и полипов форма книдоцист непостоянна и их мечение антителами к NvNcol3 происходит неравномерно (сравните рис. 3h и рис. 3i).
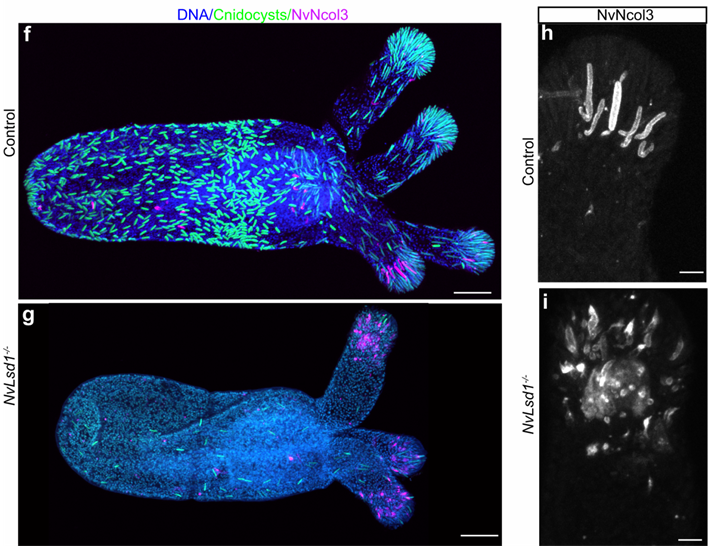 Рис. 3.
Матрикс зрелых стрекательных клеток (зелёным) и книдоцисты недозрелых стрекательных клеток (розовым) у контрольных (сверху) и мутантных NvLsd1-/-(снизу) животных. f,g – первичные полипы целиком, оральный конец справа,мо 50мкм; h,i – форма книдоцист в контроле и эксперименте, мо 10 мкм. Иллюстрации из обсуждаемой статьи Gahan et al., 2022.
Рис. 3.
Матрикс зрелых стрекательных клеток (зелёным) и книдоцисты недозрелых стрекательных клеток (розовым) у контрольных (сверху) и мутантных NvLsd1-/-(снизу) животных. f,g – первичные полипы целиком, оральный конец справа,мо 50мкм; h,i – форма книдоцист в контроле и эксперименте, мо 10 мкм. Иллюстрации из обсуждаемой статьи Gahan et al., 2022.
Исследователи ввели в зиготу N. vectensis NvLsd1-/- плазмиду, в которой нормальный аллель гена NvLsd1 находится под контролем промотора гена NvPOU4, экспрессирующегося в щупальцах полипа. В результате, авторы наблюдали формирование нормальных зрелых книдоцитов в щупальцах у мутантных животных. Однако введение аналогичной плазмиды с мутантной версией NvLsd1 или с иным геном (NvHistoneH2B в качестве контроля) не приводило к полной дифференцировке книдоцитов.
По данным авторов статьи, у актинии Nematostella наблюдается гетерогенность как в распределении мРНК NvLsd1 при синтезе фермента собственными клетками, так и в распределении материнского белка NvLsd1 у мутантных животных. Следовательно, активность гена деметилазы регулируется и на транскрипционном, и на посттранскрипционном уровне.
Повышенную экспрессию гена деметилазы мы наблюдаем в популяциях сенсорных клеток и би- / мультиполярных нейронов, то есть всех нервных клеток Nematostella. Кроме того, этот фермент имеет существенное значение для дифференцировки книдоцитов. По данным более ранних исследований, стрекательные клетки имеют общие клетки-предшественники с клетками нервной системы (см. обзор Galliot et al., 2009). Помимо того, в регуляции дифференцировки книдоцитов принимают участия те же транскрипционные факторы, что и при дифференцировке нервных клеток у Cnidaria и Bilateria (Flici et al., 2017; Rentzsch et al., 2017). По мнению авторов статьи, эти данные позволяют утверждать, что стрекательные клетки – это самостоятельная популяция нервных клеток. Таким образом, выходит, что фермент NvLsd1 как у мышей, так и у Nematostella участвует в первую очередь в нейрогенезе (Wang et al., 2007; Popova et al., 2016). Интересно, что потеря NvLsd1 приводит к отсутствию зрелых книдоцитов, однако не влияет на спецификацию клеток. Стрекательные клетки начинают дифференцироваться, но не могут довести процесс до конца. Сходная картина наблюдается при дифференцировке фоторецепторов-палочек у мышей: в этом исследовании участие фермента Lsd1 также показано именно на поздних стадиях дифференцировки клеток (Popova et al., 2016). Правда несколько не вписываются в эту картину данные по D. melanogaster и C. elegans, где никакой связи между ферментом и дифференцировкой нервной системы не было установлено, вместо этого показаны аномалии в строении женской половой системы и дифференцировке клеток половых линий при нарушениях каталитической активности деметилазы (Wang et al., 2007; Stefano et al., 2007; Katz et al., 2009).
У исследованных популяций нервных клеток Nematostella был выявлен высокий уровень экспрессии NvLsd1. При этом не удалось продемонстрировать морфологические или функциональные изменения нервных клеток при недостатке каталитически активного NvLsd1 (книдоциты не считаем). Соответственно, не удалось раскрыть роль данного фермента в дифференцировке и/или функционировании сенсорных клеток и би- / мультиполярных нейронов. Кроме того, не исключено, что белок NvLsd1 выполняет какие-то пока не известные нам функции в других типах клеток. Однако и на данном этапе можно с уверенностью сказать, что модификация гистонов, а также регуляция этих модификаций играет важную роль в дифференцировке клеток не только у Bilateria, но и у Cnidaria. Эти результаты позволяют предположить, что участие модификаций гистонов в регуляции дифференцировки клеток является древней чертой, свойственной всем Eumetazoa.
Источники:
Gahan, J. M., Kouzel, I. U., Jansen, K. O., Burkhardt, P., & Rentzsch, F. (2022). Histone demethylase Lsd1 is required for the differentiation of neural cells in Nematostella vectensis. Nature Communications, 13(1), 1-13.
Di Stefano, L., Ji, J. Y., Moon, N. S., Herr, A., & Dyson, N. (2007). Mutation of Drosophila Lsd1 disrupts H3-K4 methylation, resulting in tissue-specific defects during development. Current Biology, 17(9), 808-812.
Flici, H., Schnitzler, C. E., Millane, R. C., Govinden, G., Houlihan, A., Boomkamp, S. D., ... & Frank, U. (2017). An evolutionarily conserved SoxB-Hdac2 crosstalk regulates neurogenesis in a cnidarian. Cell reports, 18(6), 1395-1409.
Galliot, B., Quiquand, M., Ghila, L., De Rosa, R., Miljkovic-Licina, M., & Chera, S. (2009). Origins of neurogenesis, a cnidarian view. Developmental biology, 332(1), 2-24.
Katz, D. J., Edwards, T. M., Reinke, V., & Kelly, W. G. (2009). A C. elegans LSD1 demethylase contributes to germline immortality by reprogramming epigenetic memory. Cell, 137(2), 308-320.
Lee, M. G., Wynder, C., Cooch, N., &Shiekhattar, R. (2005). An essential role for CoREST in nucleosomal histone 3 lysine 4 demethylation. Nature, 437(7057), 432-435.
Popova, E. Y., Pinzon-Guzman, C., Salzberg, A. C., Zhang, S. S. M., & Barnstable, C. J. (2016). LSD1-mediated demethylation of H3K4me2 is required for the transition from late progenitor to differentiated mouse rod photoreceptor. Molecular neurobiology, 53(7), 4563-4581.
Rentzsch, F., Layden, M., & Manuel, M. (2017). The cellular and molecular basis of cnidarian neurogenesis. Wiley Interdisciplinary Reviews: Developmental Biology, 6(1), e257.
Sunagar, K., Columbus-Shenkar, Y. Y., Fridrich, A., Gutkovich, N., Aharoni, R., & Moran, Y. (2018). Cell type-specific expression profiling unravels the development and evolution of stinging cells in sea anemone. BMC biology, 16(1), 1-16.
Tunovic, S., Barkovich, J., Sherr, E. H., & Slavotinek, A. M. (2014). De novo ANKRD11 and KDM1A gene mutations in a male with features of KBG syndrome and Kabuki syndrome. American Journal of Medical Genetics Part A, 164(7), 1744-1749.
Wang, J., Scully, K., Zhu, X., Cai, L., Zhang, J., Prefontaine, G. G., ...& Rosenfeld, M. G. (2007). Opposing LSD1 complexes function in developmental gene activation and repression programmes. Nature, 446(7138), 882-887.
Новость подготовил
© Сухопутова А.В.
07.06.2022