 © Паюшина Ольга Викторовна
старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
© Паюшина Ольга Викторовна
старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
В последние годы появилось множество работ, имеющих целью получение стволовых кроветворных клеток (СКК) из плюрипотентных – прежде всего из эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток. Практическая значимость подобных исследований связана с потребностью в СКК для трансплантации пациентам с гематологическими заболеваниями, но они представляют интерес и с точки зрения фундаментальной науки, давая новые знания о механизмах регуляции гемопоэза. Основные подходы, применяемые для получения СКК – это введение в плюрипотентные клетки генов, кодирующих определенные факторы транскрипции, или их направленная дифференцировка в составе эмбриоидных тел, к которым в процессе культивирования добавляют те или иные цитокины и морфогены, воспроизводя развитие кроветворной системы в эмбриогенезе. Однако успехи в этой области пока скромны: получаемые клетки, как правило, дают различные ряды миелоидной и лимфоидной дифференцировки in vitro и in vivo, но не обладают важнейшей функциональной характеристикой СКК – способностью к длительной репопуляции кроветворных органов животного-реципиента.
Однако в мае 2017 года в журнале “Nature” вышла статья, авторы которой, сочетая два вышеупомянутых подхода, смогли получить из эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток человека кроветворные клетки, длительно восстанавливающие все ряды гемопоэза не только у первичных, но и у вторичных реципиентов, то есть обладающие способностью к самоподдержанию. Она перекликается с работой другой группы авторов (Ng E.S., Azzola L., Bruveris F.F. et al. “Differentiation of human embryonic stem cells to HOXA+ hemogenic vasculature that resembles the aorto-gonad-mesonephros”, Nature Biotechnology. 2016. doi: 10.1038/nbt.3702), посвященной получению из эмбриональных стволовых клеток клоногенных кроветворных предшественников через стадию гемогенного эндотелия (см. комментарий на сайте ИБР РАН от 07.11.2016). В настоящей работе образование гемогенного эндотелия было достигнуто тем же способом, а именно добавлением на определенных стадиях формирования эмбриоидных тел необходимых морфогенов (цитокинов, факторов роста, модуляторов сигнальных путей Wnt и активина). Эндотелиальные клетки были выделены из эмбриоидных тел путем магнитного сортинга по антигену CD34; последующее их культивирование в присутствии кроветворных цитокинов привело к так называемому эндотелиально-кроветворному переходу – снижению экспрессии генов, свойственных эндотелию, усилению экспрессии генов кроветворной дифференцировки и появлению клеток с фенотипом CD34+ CD45+. Однако, как и в вышеупомянутой работе (Ng et al., 2016), образовавшиеся кроветворные клетки не были способны к приживлению в организме облученных мышей, то есть не являлись стволовыми. Для придания им этой способности авторы использовали гены ряда специфичных для СКК факторов транскрипции. На первом этапе были выбраны 26 генов-кандидатов: 12 из них характеризовались усиленной экспрессией в СКК зародышевой печени по сравнению с гемогенным эндотелием, а остальные ранее были успешно использованы для перепрограммирования эндотелиальных, миелоидных или лимфоидных клеток в кроветворные родоначальные. Культура полученного из плюрипотентных стволовых клеток гемогенного эндотелия в состоянии эндотелиально-кроветворного перехода была трансфицирована этими 26 генами с помощью лентивирусного вектора, после чего клетки ввели сублетально облученным иммунодефицитным мышам NSG. Через 12 недель в костном мозге реципиентов были обнаружены человеческие эритроидные, миелоидные и B-клетки, а в тимусе – Т-лимфоциты. При этом в клетках донорского происхождения, принадлежащих к различным рядам гемопоэза, экспрессировались 7 из 26 введенных генов транскрипционных факторов – ERG, HOXA5, HOXA9, HOXA10, LCOR, RUNX1, SPI1. Как показали дальнейшие исследования, данные факторы необходимы и достаточны для образования СКК из гемогенного эндотелия: трансфекция этими генами клеток в состоянии эндотелиально-кроветворного перехода придавала последним ту же способность к длительной репопуляции всех рядов гемопоэза, что и введение всех 26 генов. Более того, трансфицированные генами семи транскрипционных факторов клетки восстанавливали все ряды кроветворения не только у первичных, но и у вторичных реципиентов. При этом клетки, способные приживаться в организме реципиента, появлялись лишь тогда, когда трансгены вводили в эндотелий, находящийся в процессе эндотелиально-кроветворного перехода (в том числе на ранней его стадии, когда кроветворные клетки в культуре еще не обнаруживались). Трансфекция гемогенного эндотелия, не вступившего в этот процесс, или эндотелиоцитов пупочной вены человека, к образованию трансплантабельных кроветворных клеток не приводила.
Впрочем, полученные авторами кроветворные клетки, несмотря на их соответствие таким функциональным критериям СКК, как репопулирующая способность, самоподдержание и мультипотентность, всё же отличались от истинных СКК. Глобальный транскриптомный анализ показал, что по профилю экспрессии генов они были ближе к гемогенному эндотелию, чем к СКК из пуповинной крови. При этом лишь четыре из семи трансгенов, а именно HOXA5, HOXA9, HOXA10 и SPI1, экспрессировались в них на уровне, сопоставимом с таковым в СКК, тогда как экспрессия ERG, LCOR и RUNX1 была подавлена. Имелись и функциональные различия: искусственно полученные СКК обладали меньшей, чем таковые из пуповинной крови, способностью к приживлению и не полностью воспроизводили спектр терминально дифференцированных клеток (в частности, не давали CD8+ T-лимфоцитов). По-видимому, их перепрограммирование в СКК было неполным. Авторы надеются, что дальнейшее совершенствование методики позволит получать СКК от людей с генетическими заболеваниями системы крови для тестирования методов их лечения на гуманизированных мышах, а в отдаленной перспективе – и для использования полученных клеток в терапевтических целях.
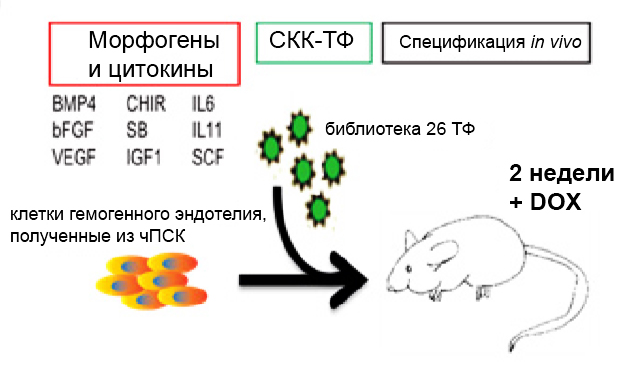 |
Рисунок. Схема скрининга библиотеки 26 факторов транскрипции (ТФ) in vivo. Гемогенный эндотелий, полученный из плюрипотентных стволовых клеток человека (чПСК), культивировали 3 суток в среде для эндотелиально-кроветворного перехода, после чего трансфицировали библиотекой 26 факторов транскрипции с помощью лентивирусного вектора, индуцируемого доксициклином (DOX). Трансфицированные клетки (100 000) инъецировали в бедро сублетально облученных (250 рад) мышей NSG, в течение последующих 2 недель получавших с пищей и питьевой водой доксициклин для индукции экспрессии трансгенов.
Новость подготовила © 2017 Паюшина О.В.
07.06.2017