doi: 10.1016/j.cell.2021.03.020
 © Косых Анастасия Валерьевна, младший научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
© Косых Анастасия Валерьевна, младший научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
Химера — организм, состоящий из генетически разнородных клеток. Работы по созданию химерных животных начинались с использованием клеточного материала от одного вида. На таких моделях изучали процессы эмбрионального развития, ткане- и органогенеза. В дальнейшем возникла идея об использовании данной техники в регенеративной медицине для «выращивания» в организме животного человеческих органов и тканей для трансплантации. Проводилось множество работ по получению определенных тканей и органов крысы (эндотелий, поджелудочная железа) в организме мыши. Создатели межвидовых химер столкнулись со множеством технических сложностей, поскольку клетки другого вида неохотно приживались и встраивались в организм реципиента в процессе эмбриогенеза. Помимо этого, использование клеток человека сопряжено со множеством правовых и этических трудностей.
Авторы данной статьи ранее проводили эксперименты по созданию химерных эмбрионов на основе бластоцист мыши и свиньи. По итогам предыдущих работ они отметили, что эффективность химеризма зависит от эволюционной близости донора и реципиента. Так, при инъекции клеток крысы в бластоцисту мыши формировалась химера, однако в бластоцисте свиньи включения клеток мыши не происходило. В других работах авторы продемонстрировали развитие химеры из бластоцисты свиньи после инъекции iPS человека. Проблемы интеркаляции клеток авторы связывают с отличиями эмбрионального развития донора и реципиента, проявляющимися на молекулярном и клеточном уровнях – избирательная адгезия клеток, несовместимость лиганд-рецепторных взаимодействий, компетенции клеток и отличиях в клеточных циклах, темпах и сроках развития. В данной статье в качестве реципиента был выбран более близкий человеку вид - Макак-крабоед (лат. Macaca fascicularis) или яванский макак, донорские клетки iPS1-EPSCs были отобраны на основании анализа колоний и экспрессии факторов плюрипотентности (OCT4, NANOG и SOX2).
В своем эксперименте авторы инъецировали 25 клеток iPS1-EPSCs с флуоресцентной меткой tdTomato (TD+) в эмбрион обезьяны на стадии ранней бластоцисты (6 сутки после оплодотворения – Е6) и отслеживали развитие эмбриона до и после имплантации в культуре, а также вклад iPS1-EPSCs в структуры эмбриона до 20 суток после оплодотворения (20Е) (Рис.1).
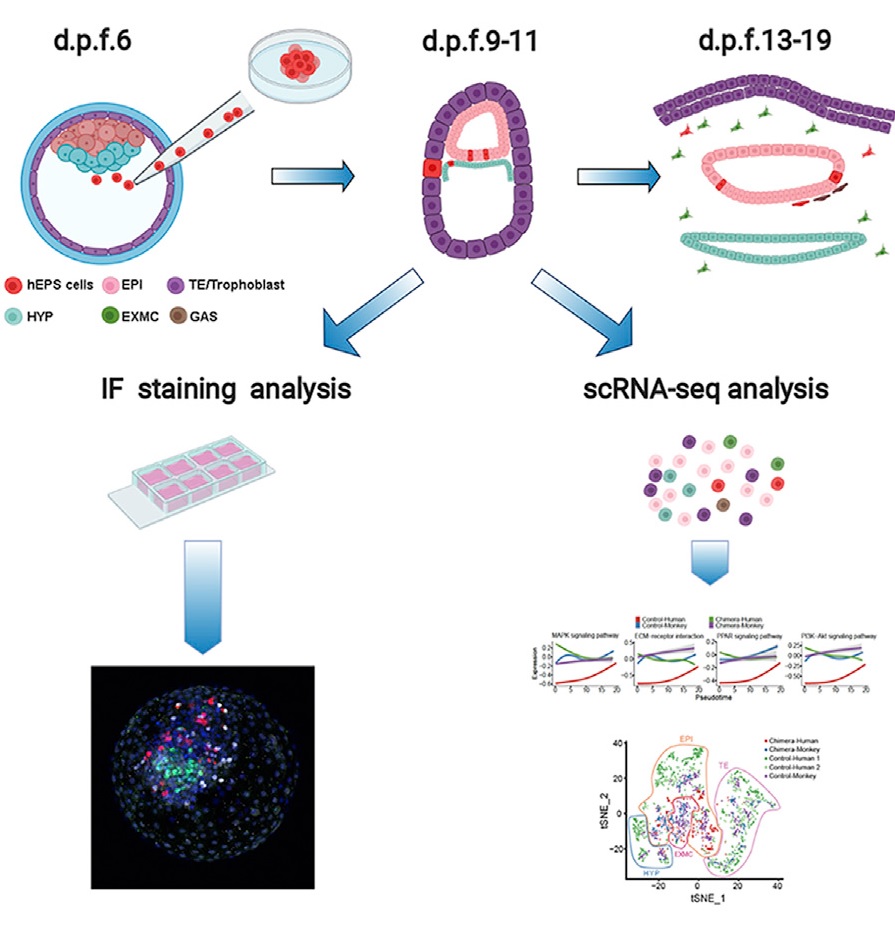
Рисунок 1. Схема создания и анализа химерных эмбрионов, полученных в результате инъекции hEPSC в бластоцисту обезьяны. hEPSCs - плюрипотентные стволовые клетки человека; EPI - эпибласт; HYP - гипобласт; TE - трофэктодерма; EXMC - внеэмбриональные мезенхимные клетки; GAS - клетка гаструлы; IF - иммунофлуоресценция.
Общий анализ показал, что экспериментальные эмбрионы (n=132) развивались немного медленнее контрольных (n=104). Анализ доимплантационных эмбрионов (Е9) показал, что TD+ клетки встречаются в основном в ВКМ (внутренней клеточной массе) и экспрессируют характерные маркеры слоя (OCT4, NANOG), и лишь единичные клетки в трофобласте (TFAP2C, CK7) (Рис.2, A-D). Авторы показали, что TD+ клетки сохраняются в эмбрионе после имплантации вплоть до Е19 и на разных стадиях экспрессируют маркеры гипобласта (PDGFRa), внеэмбриональных мезенхимных клеток (COL6A1), гаструляции (Brachyury, OTX2) энтодермы (SOX17) (Рис.2, E-F).
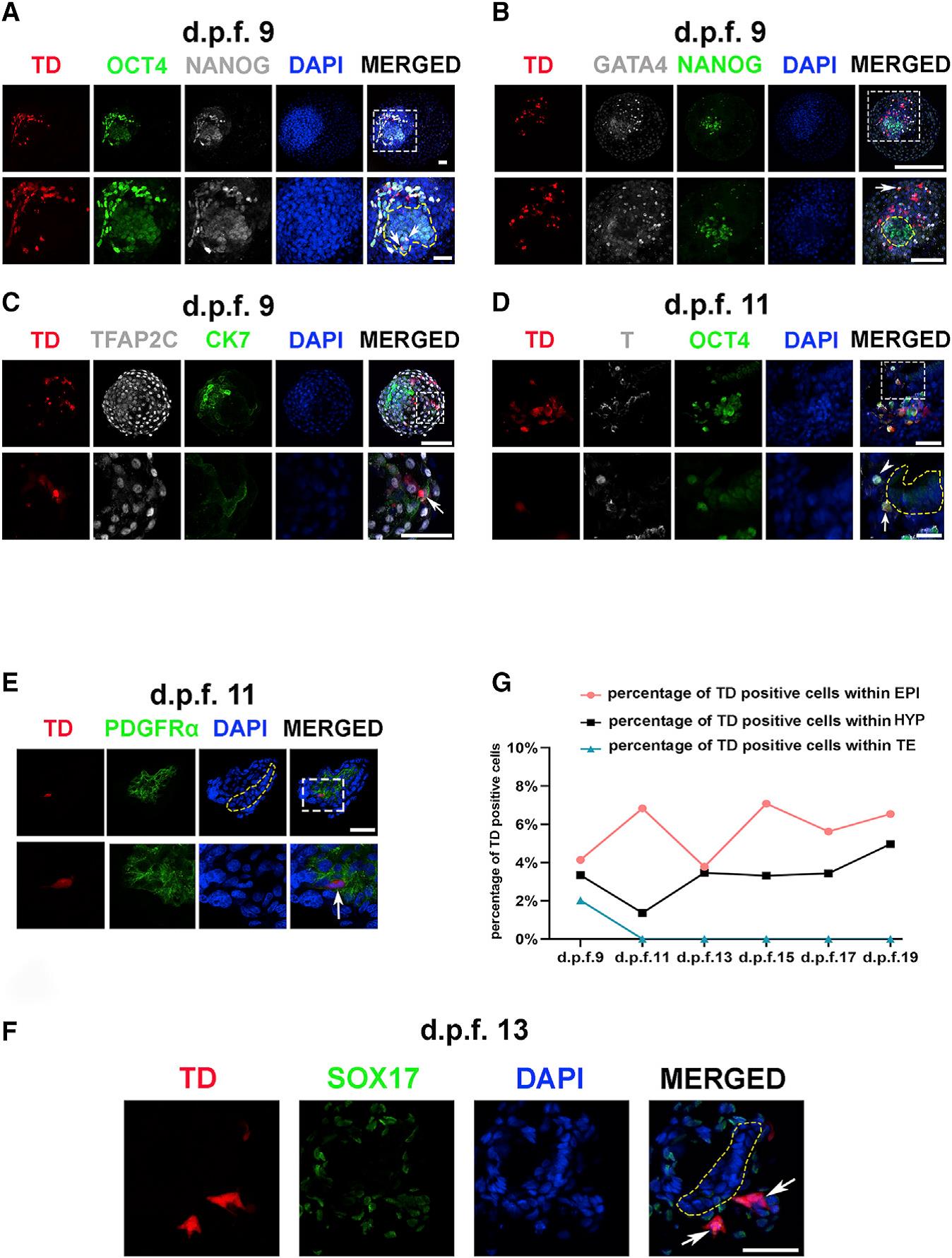
Рисунок 2. Вклад hEPSC в формирование химеры в до- и постимплантационный периоды развития эмбрионов обезьяны
(A) интеграция TD+клеток hEPSC в ВКМ эмбриона обезьяны, d.p.f.9(Е9) (n = 7). Эмбрионы окрашены на OCT4 (зеленый) и NANOG (серый). Масштабный отрезок - 250 мкм(верхний ряд), 50мкм(нижний ряд). Стрелки указывают на TD+ hEPSC, экспрессирующие OCT4 и NANOG. Желтая пунктирная линия обозначает ВКМ.
(B) hEPSC, дифференцировавшиеся в клетки гипобласта, d.p.f.9(Е9). Эмбрионы окрашены на GATA4 (серый) и NANOG (зеленый). Масштабный отрезок - 250 мкм(верхний ряд), 100мкм(нижний ряд). Стрелки указывают на TD+ hEPSC, экспрессирующие GATA4. Желтая пунктирная линия обозначает ВКМ.
(C) интеграция TD+ hEPSC в трофэктодерму эмбриона обезьяны, d.p.f.9(Е9) (n = 3). Эмбрионы окрашены на TFAP2C (серый) и CK7 (зеленый). Масштабный отрезок - 100 мкм(верхний ряд), 50мкм(нижний ряд). Стрелки указывает на TD+ hEPSC, экспрессирующие TFAP2C и CK7.
(D) интеграция hEPSCs в эпибласт эмбриона обезьяны, d.p.f.11(Е11) (n = 3). Эмбрионы окрашены на Т (серый) и OCT4 (зеленый). Масштабный отрезок - 250 мкм(верхний ряд), 25мкм(нижний ряд). Желтая пунктирная линия обозначает эпибласт.
(E) Экспрессия маркера гипобласта PDGFR(зеленый) в hEPSC, d.p.f.11(Е11) (n = 2). ). Масштабный отрезок - 50 мкм(верхний ряд), 10мкм(нижний ряд).. Внизу: увеличения вставки (белая пунктирная линия) вверху панель. Стрелки указывает на TD+ hEPSC, экспрессирующие PDGFRa. Желтая пунктирная линия обозначает эпибласт.
(F) Срез эмбриона обезьяны, d.p.f.13 (Е13) (n = 5,) окрашивание на SOX17 (зеленый). Стрелки указывают на TD+ hEPSC, экспрессирующие SOX17. Масштабный отрезок - 50 мкм. Желтая пунктирная линия обозначает эпибласт.
(G) Уровни химеризма hEPSC в эпибласте, гипобласте и трофобласте. Клетки эпибласта экспрессировали только ОСТ4, а клетки гипобласта экспрессировали GATA6 и / или GATA4, тогда как в трофэктодерме экспрессировался CK7 (всего проанализировано 25 эмбрионов и 17 938 клеток).
Для дальнейшего транскриптомного анализа авторы разобрали эмбрион и отсортировали на клетки человека (TD+) и обезьяны (TD-). В первую очередь они подтвердили, что клетки человека дифференцировались в клетки эпибласта, гипобласта, трофобласта и внеэмбриональные мезенхимные клетки. Единственное различие заключалось в том, что клетки обезьяны демонстрировали более точное разделение на клоны.
Интересные результаты получились при сравнении клеток человека и обезьяны из химерного эмбриона с клетками обоих видов из интактных эмбрионов. Авторы показали, что транскриптомы клеток химер отличались от чистых образцов и особо отметили, что эпибластные клетки человека были ближе к человеческому контролю, а клетки гипобласта и внеэмбриональных МСК к соответствующим типам клеток обезьяны, выделенным из химерного эмбриона. Изучение динамики транскрипции в клетках химер показало, что эпибластные клетки человека с момента имплантации до гаструляции все больше коррелировали с клетками эпибласта обезьяны (Рис.3). В связи с этим, следующим этапом работы стало изучение взаимного влияния клеточных компонентов химеры.
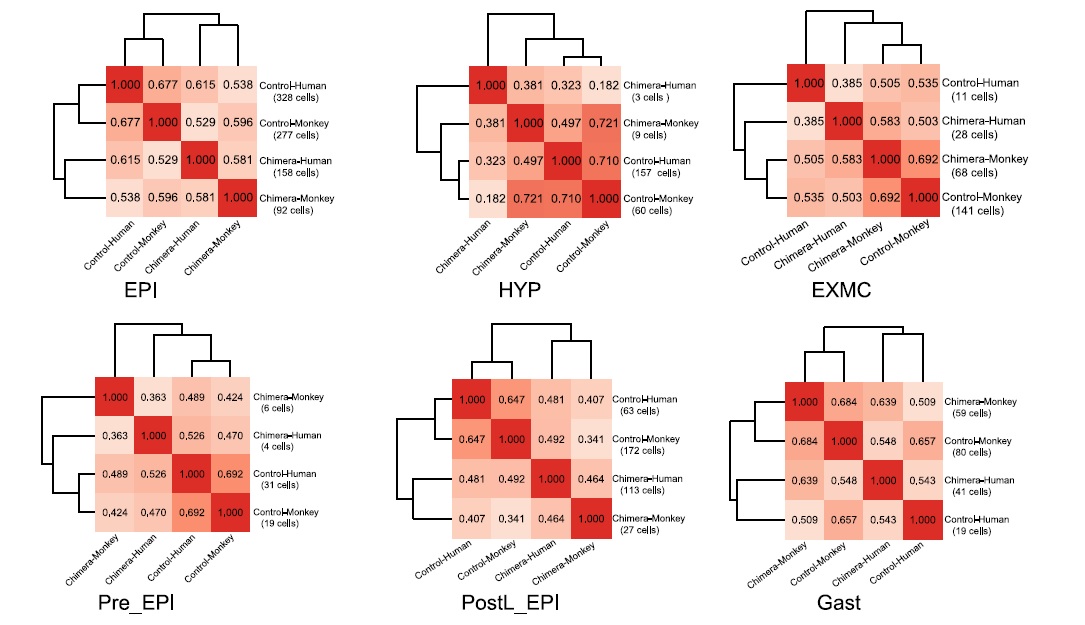
Рисунок 3. Тепловая карта коэффициентов корреляции между разными типами клеток на разных стадиях развития(EPI - эпибласт, EXMC - внеэмбриональные мезенхимные клетки, HYP- гипобласт, Pre_EPI – доимплантационный эпибласт, PostL_EPI – постимплантационный эпибласт и Gast - гаструла).
Используя KEGG (Kyoto Encyclopedia of Genes and Genomes), авторы показали, что межклеточные взаимодействия в химерном эмбрионе усиливаются, например, FGF5-FGFR4, NOTCH4-JAG2, WNT2B-FZD4, WISP3-SORL1 и PLXNB2-PTN лиганд-рецепторные взаимодействия, что вероятно приводит к активации дополнительных сигнальных каскадов (PI3K-Akt, MAPK, WNT signaling pathways).
Особое внимание авторы уделили клеткам человека в эпибласте (EPI), поскольку развитие эпибласта сопровождается изменениями плюрипотентности, динамика которых может отличаться среди видов, что может влиять на формирование химеры. При изучении профиля транскрипции клеток, авторы отметили, что клетки человека из химерного эмбриона дифференцируются медленнее, в сравнении с клетками реципиента, а также клетками в интактных эмбрионах обезьяны и человека. С помощью анализа KEGG были выявлены PI3K-Akt, MAPK и PPAR (Peroxisome proliferator-activated receptor) сигнальные путь, с помощью которых вероятно происходит сдвиг транскриптома клеток эпибласта человека в сторону клеток обезьяны в составе химерного эмбриона (Рис. 4).
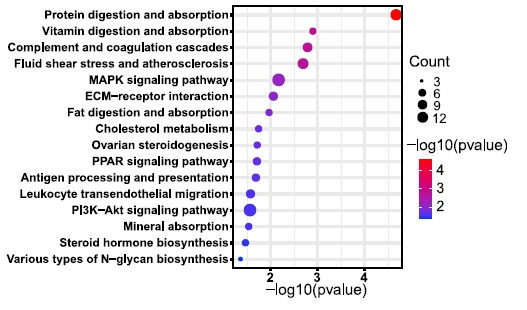
Рисунок 4. KEGG анализ 315 DEGs (different expression genes)
Авторы также выявили гены, которые потенциально могут играть важную роль в регуляции развития химерных клеток эпибласта, а именно CHD2, POLR2A и RB1. Таким образом, авторами были выявлены сигнальные пути и факторы, которые вероятно определяют специфику и динамику дифференцировки клеток человека в составе эпибласта химеры.
В данной работе авторы предлагают свою модель для изучения ранних этапов эмбрионального развития, хотя сами признают, что основным лимитирующим фактором является труднодоступность донорского материала. Однако, несомненным плюсом является наличие внезародышевых структур, наличие которых позволяет максимально приблизить культуральные условия к уровню in vivo. Показано, что клетки человека в эмбрионе обезьяны включаются в эмбриональные и внешние структуры на до- и ранних постимплантационых этапах развития. Отмечены транскриптомные изменения в клетках химер, в сравнении с интактными эмбрионами обоих видов. Также были обозначены сигнальные пути (PI3K-Akt, MAPK), воздействуя на которые, вероятно можно будет увеличить эффективность получения межвидовых химер. Был собран большой массив данных по взаимодействию клеток донора и реципиента в химерном эмбрионе, что, помимо всего прочего, имеет значение и для изучения эволюционных процессов.
В дальнейшем авторы планируют продолжить нарабатывать материал, поскольку образование химер достаточно хаотичный процесс (со стадии Е7 до Е13 количество эмбрионов с TD+ клетками уменьшилось в 3 раза, а часть данных показана для 3-5 эмбрионов). Кроме того, планируется изучение других донорских клеточных линий, поскольку вероятно существует зависимость эффективности химеризма от пролиферативной активности и/или жизнеспособности инъецируемых клеток. Также в планах указывается изучение данной модели с использованием разного числа донорских клеток и эмбрионов других стадий развития.
Новость подготовила © Косых А.В.
07.05.2021