Комментарий к статье «The role of cancer-associated fibroblasts in tumorigenesis of gastric cancer» Sun, H., Wang, X., Wang, X. et al. Cell Death Dis 13, 874 (2022). https://doi.org/10.1038/s41419-022-05320-8
Рак желудка (РЖ) является одной из наиболее злокачественных опухолей желудочно-кишечного тракта и занимает четвертое место среди причин смертности от рака во всем мире. В 2020 г. было зарегистрировано около 1,03 миллиона новых случаев и 0,79 миллиона смертей от РЖ.
Общие факторы риска развития рака желудка (РЖ) включают пожилой возраст, мужской пол, курение табака, радиацию и семейный анамнез. Другими факторами являются ожирение, инфекция Helicobacter pylori, гастроэзофагеальная рефлюксная болезнь и диета (например, высокое потребление соленой пищи или низкое потребление витаминов А и С), нитрозамины, химические вещества, копченая пища и высокое потребление алкоголя (Karimi P, 2014).
Пациенты с запущенными опухолями с метастазами получают традиционные варианты лечения: хирургическое удаление опухоли с последующей лучевой и химиотерапией. Однако, химиорезистентность является одной из основных причин неэффективности лечения.
Новые методы лечения рака направлены на стимуляцию иммунной системы для устранения раковых стволовых клеток и восстановления противоопухолевого иммунитета. Ингибиторы контрольных точек иммунного ответа, такие как ингибиторы CTLA-4 и PD-1 тремелимумаб и ниволумаб, обладают ограниченной активностью. Тем не менее, такие вещества в клинических исследованиях показали повышение выживаемости пациентов с раком желудка (Wang D.-K., 2021; Yang L., 2019). Недавно CAR-T-клетки также были применены при опухолях желудочно-кишечного тракта против антигенов, таких как рецептор 2 эпидермального фактора роста (HER2), карциноэмбриональный антиген (CEA), муцин 1 (MUC1) и молекула адгезии эпителиальных клеток (EpCAM) для задержки роста опухоли в мышиных моделях (Dominika B., 2020). CAR-T-клетки, нацеленные на EpCAM, проходят клинические испытания (NCT02617134 и NCT02725125) для оценки их безопасности и эффективности (Yang L., 2019).
Несмотря на растущий набор терапий рака желудочно-кишечного тракта, прогноз пациентов с распространенным раком желудка остается неудовлетворительным из-за высокой частоты рецидивов опухоли и дистальных метастазов. Таким образом, для выявления новых терапевтических мишеней и новых стратегий для обеспечения эффективного лечения все еще необходимо исследовать молекулярные и клеточные механизмы прогрессии и метастазирования опухоли.
В обзоре «The role of cancer-associated fibroblasts in tumorigenesis of gastric cancer» авторы делают акцент на роли ассоциированных с опухолью фибробластов (CAF), как одном из компонентов опухолевого микроокружения, в злокачественном онкогенезе и прогрессировании опухолевого процесса.
CAF – представляют гетерогенную группу стромальных клеток опухоли, отличающихся происхождением, фенотипом и функциональным разнообразием. На рисунке 1 авторы отобразили источники происхождения CAF.
Фенотипическое разнообразие CAF зависит как от экспрессии молекулярного маркера, так и от конкретного опухолевого микроокружения. Наиболее распространёнными маркерами CAF являются альфа-актин гладких мышц (α-SMA), белок активации фибробластов (FAP), специфический для фибробластов белок 1 (FSP1/S100A4), виментин, подопланин (PDPN), рецепторы тромбоцитарного фактора роста (PDGFRα/β), кавеолин-1, мефлин, CD10 и GPR77. Однако, ни один из этих маркеров не является уникальным для CAF. Несущие тот или иной маркер CAF могут обладать разным функциональным значением для развития и прогрессии опухоли.
Функциональное разнообразие CAF на развитие и прогрессию опухолей обусловлено множеством секретируемых ими регуляторных молекул и белков внеклеточного матрикса (рисунок 2).
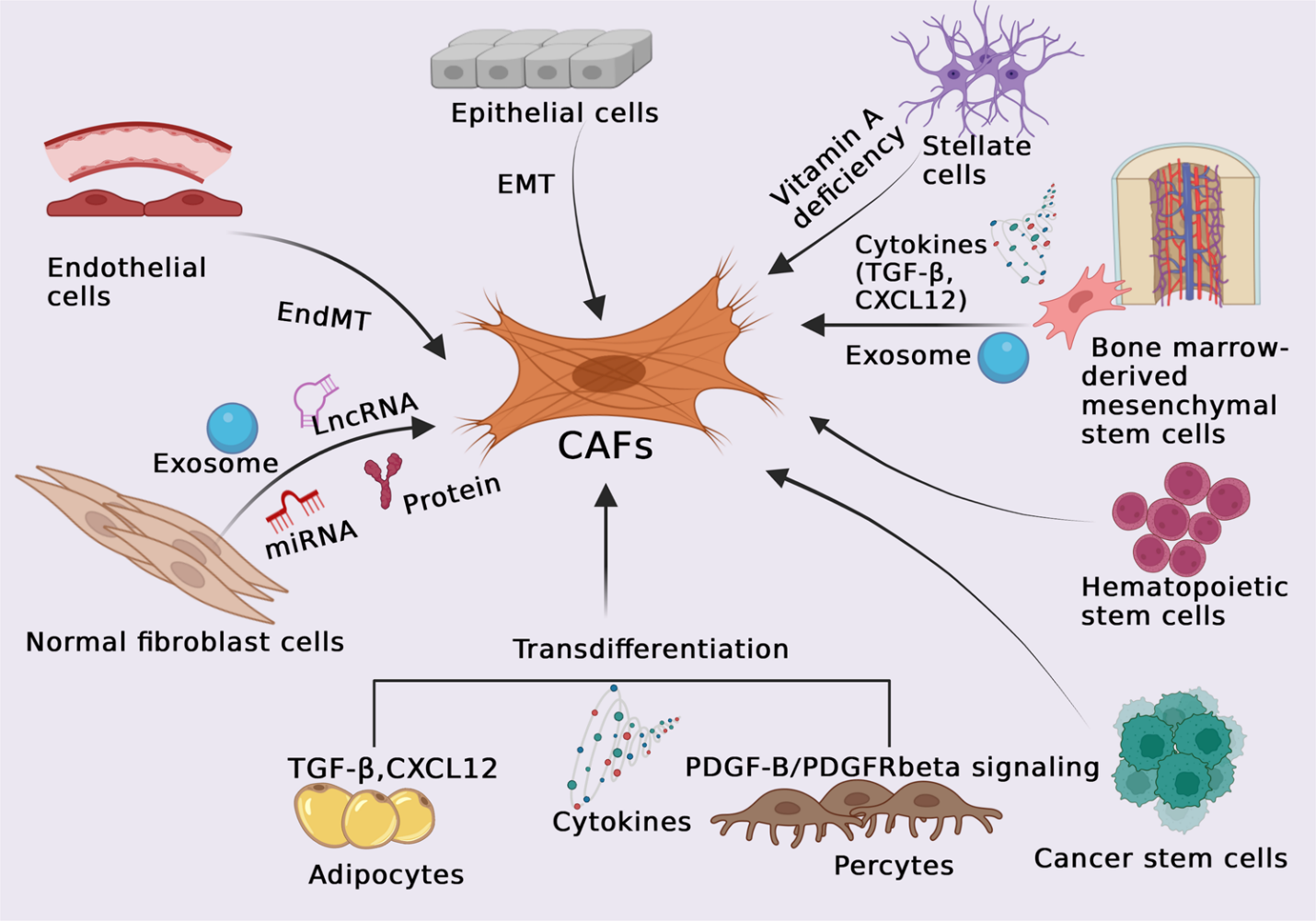
Рис. 1.
Разнообразие происхождения CAF. Разные типы клеток могут быть активированы и рекрутированы в качестве предшественников CAF: нормальные фибробласты, эпителиальные клетки (через эпителиально-мезенхимальный переход), эндотелиальные клетки (через эндотелиально-мезенхимальный переход), перитуморальные адипоциты, перициты, гемопоэтические стволовые клетки, мезенхимальные стволовые клетки костного мозга (СКМСК) и раковые стволовые клетки.
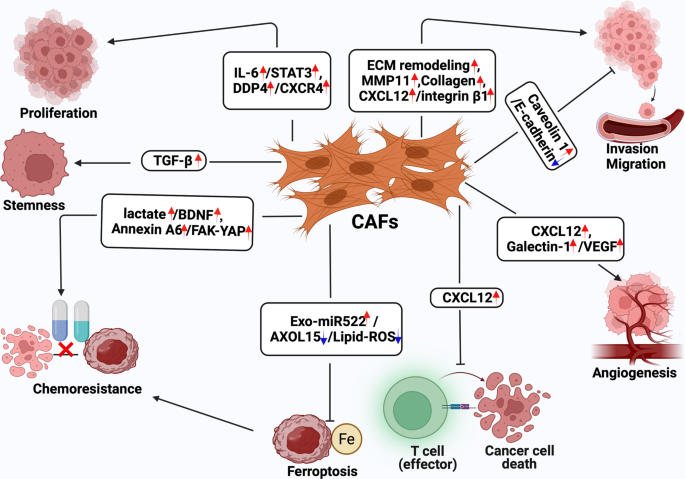
Рис. 2.
Функциональная неоднородность CAF. CAF влияют на пролиферацию раковых клеток, их стволовость, метаболические изменения и химиорезистентность, инвазию, миграцию, эпителио-мезенхимный переход, ангиогенез и иммуносупрессию при раке желудка за счет разнообразия паракринных факторов.
При раке желудка CAF способствуют пролиферации опухолевых клеток за счет секреции IL-6, который индуцирует активацию STAT3 в раковых клетках, и секреции дипептидилпептидазы-4 (DPP-4), чей рецептор CXCR4 экспрессируется в опухолевых клетках. Секретируемый CAF хемокин CXCL12 способствует инвазии клеток рака желудка, усилению противовоспалительной среды микроокружения опухоли, а также стимулирует неоваскуляризацию. CAF секретируют ряд других проангиогенных факторов - VEGFA, PDGFC, FGF2, galectin-1. Внеклеточный матрикс, секретируемый CAF, также может способствовать эпителио-мезенхимному переходу при РЖ. CAF проявляют иммуносупрессивные свойства, что позволяет опухоли ускользать от иммунологического контроля. За счет секреции miR-522 CAF подавляют ферроптоз и способствуют химиорезистентности при РЖ. Помимо miR-522, секретируемые CAF Аннексин-6 и BDNF влияют на химиорезистентность при РЖ.
Отдельное внимание авторы обзора уделяют перекрестным взаимодействиям между CAF и опухолевыми клетками. Образование градиента хемоаттрактанта (CXCL12) за счет формирования положительно обратных связей между раковыми клетками и CAF является одним из механизмов управления миграцией и содействия эпителио-мезенхимному переходу раковых клеток. Экзосомы, секретируемые опухолевыми или мезенхимальными клетками, обеспечивают перенос растворимых цитокинов, функциональных фрагментов ДНК и РНК в мезенхимальные клетки, что дополнительно способствует их активации (miR-522). Непосредственный контакт опухолевых клеток и CAF (гетеротипические взаимодействия E-кадгерин/N-кадгерин, нектин/афадин) необходим для инвазии опухолевых клеток и миграции CAF.
В обзоре также обсуждаются функциональные белки (Twist1, кавеолин-1, PKM2, THBS1) микро РНК (miRNAs) (miR-214, miR-139, miR-141, miR-506) и lncRNAs (FLJ22447), селективно экспрессируемые в CAF, которые могут быть диагностическими биомаркерами и генами-кандидатами-мишенями для терапии рака желудка.
Данная обзорная статья выдвигает CAF как новый объект для исследований механизмов канцерогенеза и поиска новых стратегий для терапии РЖ.
Karimi, P.; Islami, F.; Anandasabapathy, S.; Freedman, N.D.; Kamangar, F. Gastric Cancer: Descriptive Epidemiology, Risk Factors, Screening, and Prevention. Cancer Epidemiol. Biomark. Prev. 2014, 23, 700–713.
Wang, D.-K.; Zuo, Q.; He, Q.-Y.; Li, B. Targeted Immunotherapies in Gastrointestinal Cancer: From Molecular Mechanisms to Implications. Front. Immunol. 2021, 12, 705999.
Dominika, B. CAR-T Cell Therapy—An Overview of Targets in Gastric Cancer. J. Clin. Med. 2020, 9, 1894.
Yang, L.; Wang, Y.; Wang, H. Use of immunotherapy in the treatment of gastric cancer (Review). Oncol. Lett. 2019, 18, 5681–5690.
Новость подготовила
© Киселева Екатерина Владимировна,
06.12.2022
 ©
©