Kong J.H., Young C.B., Pusapati G.V., et al. Gene-teratogen interactions influence the penetrance of birth defects by altering Hedgehog signaling strength. Development. 2021. 148(19):dev199867. doi: 10.1242/dev.199867.
Lo H., Hong M., Szutorisz H., et al. Δ9-Tetrahydrocannabinol inhibits Hedgehog-dependent patterning during development // Development. 2021. 48(19):dev199585. doi: 10.1242/dev.199585.


© Гайдамака Анна, аспирант лаборатории клеточной биологии. Область научных интересов: эндометрий, стволовые клетки эндометрия, модели имплантации эмбриона.
© Каримова Марьяна, аспирант лаборатории клеточной биологии. Область научных интересов: биология развития, регенеративная медицина, клеточные дифференцировки, панкреатические beta-клетки.
Фенотипическое проявление признака определяется не только генотипом, но и действием факторов внешней среды, а также случайными процессами. В связи с этим нередко сложно определить частоту и степень проявления дефектов развития в тех или иных тканях. Изучение молекулярных механизмов, отвечающих за нормальное развитие и проявление его нарушений, позволяет приблизиться к пониманию процесса формирования фенотипа.
Сигнальный путь Hedgehod (HH) участвует во множестве процессов эмбриогенеза и широко исследуется в контексте взаимодействия среды и генов. Он отвечает за разметку и морфогенез многих тканей и органов, причем его влияние специфично для каждой развивающейся структуры. Лиганды HH являются морфогенами, формирующими пространственно-временные градиенты в тканях. Конечный результат их воздействия зависит от силы и продолжительности передачи сигналов в клетках-мишенях. Это отличает HH от некоторых других сигнальных путей, работающих по принципу бинарных переключателей. Сигнальный путь HH вызывает особый интерес среди исследователей, поскольку его активность влияет на определение судьбы клеток: даже небольшие отклонения сигналов HH от нормальных значений могут вызывать различные врожденные патологии. Одной из возможных причин этих отклонений может являться воздействие факторов внешней среды на элементы сигнального пути HH в ходе морфогенезов.
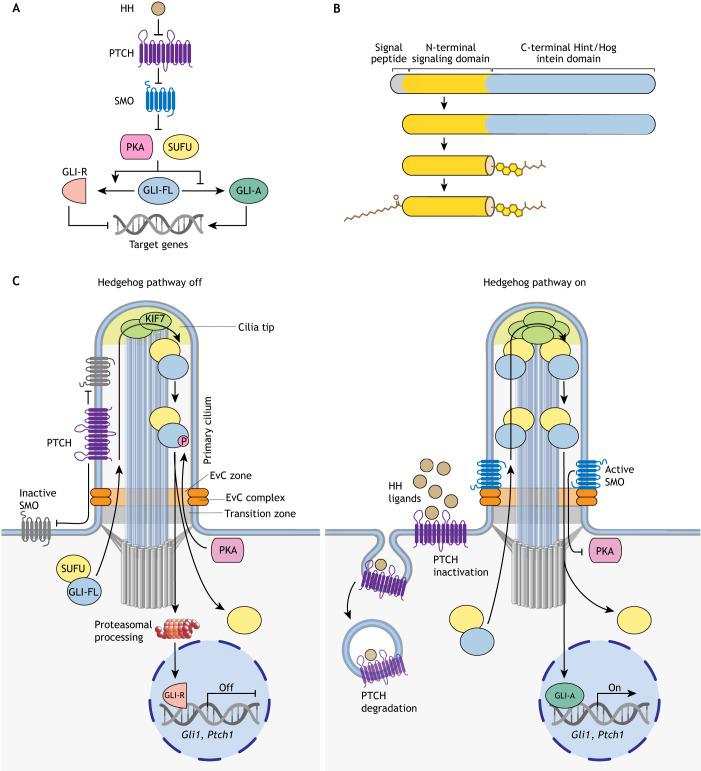
Рис. 1. Схема сигнального пути Hedgehog (Kong et al., 2019).
Передача сигнала в каскаде HH построена на серии ингибирующих взаимодействий. Первым этапом формирования сигнала является связывание лиганда HH с мембранным рецептором PTCH (Patched protein receptor). Это, в свою очередь, приводит к активации и накоплению трансмембранного белка SMO (Smoothened), который участвует в дальнейшей передаче сигнала в клетку. В отсутствие лиганда PTCH подавляет передачу сигнала через SMO. Когда SMO неактивен, два ингибирующих компонента - SUFU (Suppressor of Fused) и протеинкиназа A (PKA) - сдерживают активность транскрипционных факторов семейства GLI путем прямого взаимодействия и фосфорилирования. Белки SUFU и PKA преобразуют GLI-FL в неактивный GLI-R, который не транспортируется в ядро и не активирует транскрипцию генов-мишеней. При активации SMO происходит диссоциация GLI-FL от SUFU, и он не подвергается преобразованию в GLI-R. В итоге GLI-FL способен перемещаться в ядро и запускать экспрессию генов (Рис. 1).
Как было сказано выше, интенсивность передачи сигнала в каскаде HH определяет, каким образом будет идти развитие тканей эмбриона: либо оно пойдет по основной траектории, либо дополнительные факторы изменят его направление. В работе Jennifer Kong с соавторами было исследовано влияние генетических и средовых факторов на компоненты сигнального пути HH, и, как следствие, на степень проявления различных дефектов развития (Kong et al., 2021).
Для того, чтобы оценить влияние генотипа на будущий фенотип, были получены эмбрионы мыши, нокаутные по гену Mosmo (Mosmo-/-). Этот ген кодирует мембранный белок, участвующий в ослаблении активности пути HH. Мишенью MASMO является белок SMO, который отвечает за чувствительность клеток к HH лигандам. Развитие мышей Mosmo -/- останавливалось на стадии E14.5 ввиду серьезных нарушений формирования сердца, легких и скелета (Рис. 2). Кроме того, у всех эмбрионов была выявлена гетеротаксия некоторых внутренних органов и полидактилия передних и задних конечностей (Рис. 2С). Оказалось, что у этих эмбрионов происходит повышение активности сигнального пути HH за счет усиленного накопления SMO клетками на цитоплазматической мембране в области первичных ресничек (Рис. 3B). Это, в свою очередь, привело к повышению экспрессии фактора транскрипции Gli1 в органах, имеющих наиболее морфологически выраженные дефекты развития (Рис. 3A).
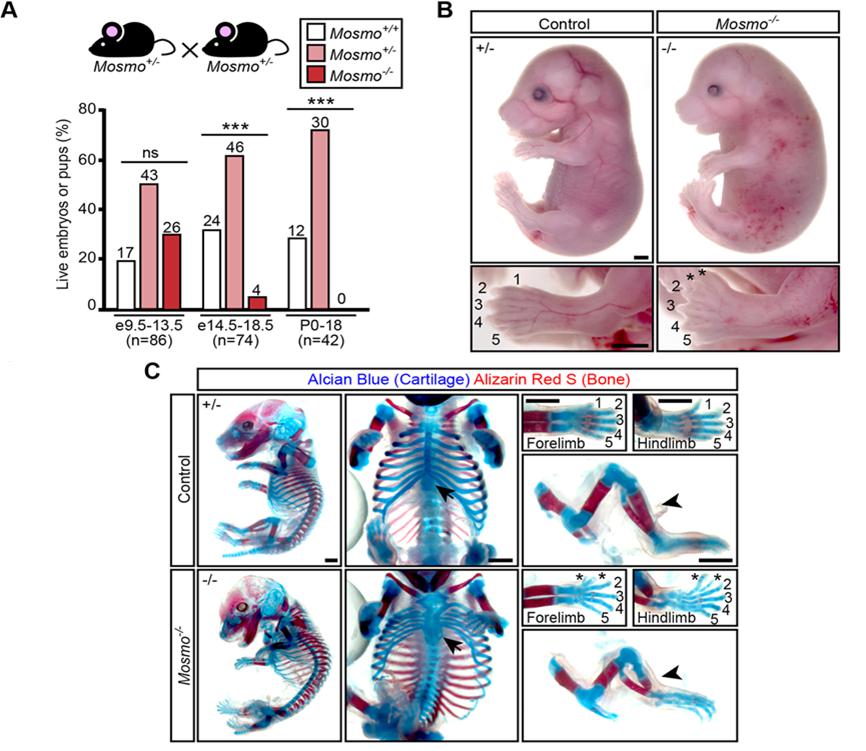
Рис. 2. Нокаут Mosmo приводит к возрастанию уровня летальности и множественным дефектам развития. (А) Жизнеспособность эмбрионов, полученных путем скрещивания особей Mosmo+/− × Mosmo+/−, на разных стадиях развития. (В) Фенотип особей Mosmo+/− и Mosmo−/−. (С) Скелеты эмбрионов Mosmo+/− и Mosmo−/−, окрашенные альциановым синим и ализариновым красным (Kong et al., 2021).
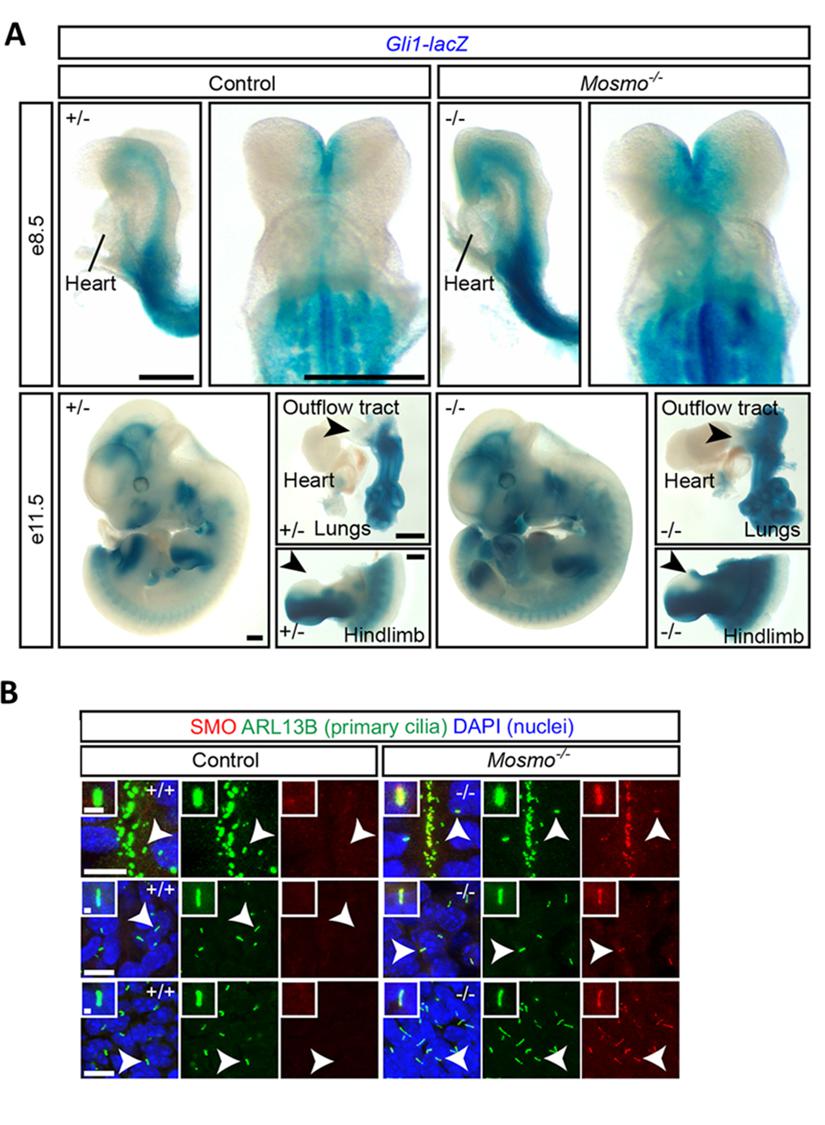
Рис. 3. Нокаут Mosmo приводит к повышению активности сигнального пути HH. (A) Окрашивание X-gal было использовано для того, чтобы выявить экспрессию Gli1-lacZ в эмбрионах мыши Mosmo+/− и Mosmo−/−. (B) Изменение интенсивности иммунофлюоресценции SMO в области первичной реснички у эмбрионов мыши Mosmo+/− и Mosmo−/− (Kong et al., 2021).
Авторы этого исследования показали, что MASMO уникальным образом настраивает градиент передачи сигналов HH в клетках-мишенях путем деградации SMO, и тем самым способствует нормальному развитию. Далее было необходимо узнать, каким образом будут взаимодействовать фактор окружающей среды и внесенная ранее мутация. Для этого беременным самкам мыши вводили перорально низкомолекулярный антагонист SMO - висмодегиб, который является тератогеном и свободно проходит через плацентарный барьер. Висмодегиб связывается с трансмембранным белком SMO и препятствует дальнейшей передаче сигнала по пути HH. У эмбрионов дикого типа он вызывал олигодактилию, нарушения формирования нервной трубки и дефекты развития выносящего тракта сердца. Однако у эмбрионов Mosmo-/- нервная трубка и выносящий тракт сердца оказались устойчивы к воздействию висмодегиба, вероятно, за счет увеличения количества SMO, связанного с внесенной мутацией. Это может говорить в пользу того, что избыток SMO защищает эмбрионы от тератогенных эффектов висмодегиба. Наиболее поразительные изменения наблюдались в развитии конечностей: обработка висмодегибом восстанавливала их нормальный фенотип у эмбрионов Mosmo-/-. Кроме того, повышался уровень выживаемости мутантных особей.
Отсюда следует, что предрасположенность к врожденным дефектам зависит не сколько от генотипа развивающегося эмбриона, а скорее от его взаимодействия с факторами окружающей среды. Эта идея дает почву для новых исследований, которые будут направлены на изучение роли тератогенов в изменении пенетрантности и экспрессивности врожденных дефектов, а также возможности применения этих низкомолекулярных соединений в клинической практике.
Генетически обусловленные изменения в активности сигнального пути HH могут и не проявляться в фенотипе без определенных воздействий внешних факторов. Так, Hsiao-Fan Lo с соавторами показали, что психоактивный каннабиноид Δ9- тетрагидроканнабинол (THC) вызывает голопрозэнцефалию (HPE) и нарушения разметки вентральной части нервной трубки у мышей, нокаутных по гену одного из корецепторов сигнального пути HH (Cdon-/-) (Lo et al., 2021). Авторов статьи интересовали вопросы корреляции мутации в гене Cdon с проявлением нарушений, а также механизм действия THC на белки сигнального пути HH.
Было показано, что введение THC беременным самкам не оказывало влияния на развитие HPE у эмбрионов дикого типа и Cdon+/−. Однако у особей Cdon−/− проявлялась HPE, причем выраженность этого дефекта зависела от дозы THC. У этих эмбрионов на стадии E9.5 уровни экспрессии мРНК транскрипционных факторов сигнального пути HH, а именно Gli1, Nkx2-1 и Shh, были значительно ниже, чем у контрольных особей (Рис. 4).
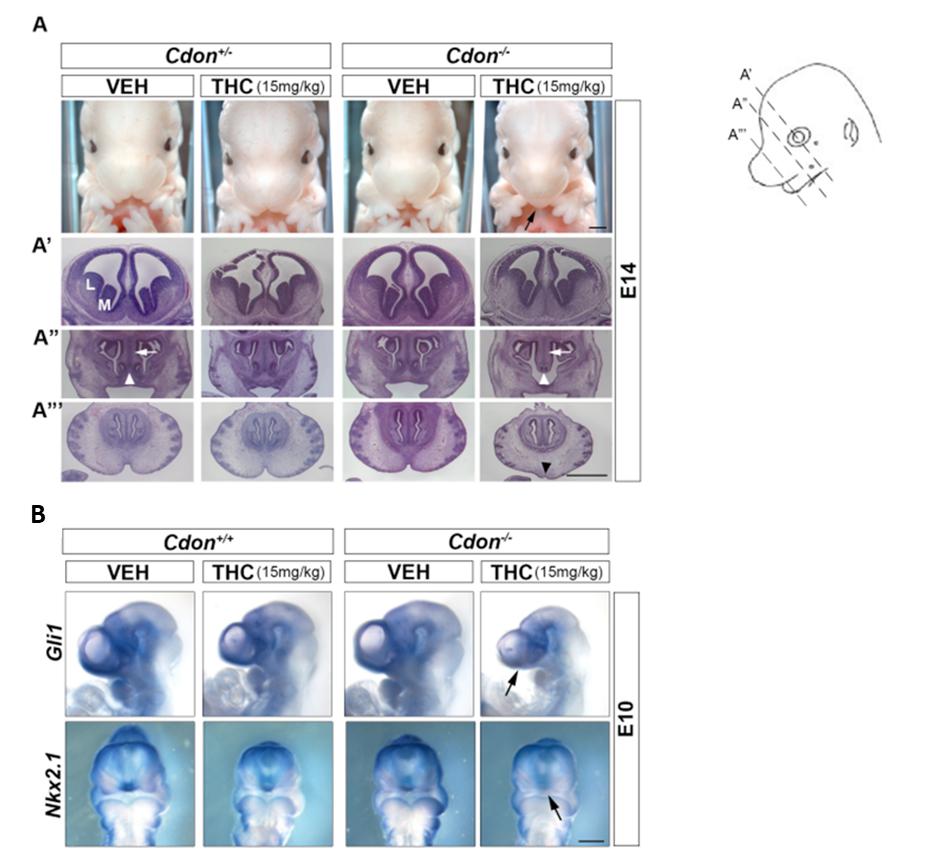
Рис. 4. THC приводит к появлению HPE у мышей, нокаутных по Cdon. (A) Фенотип особей Cdon+/− и Cdon−/− в зависимости от введения THC. (A’-A’’’) Гистологические препараты мозга этих особей. (B) Определение уровня экспрессии мРНК Nkx2.1 и Gli1 методом in-situ гибридизации (Lo H. et al., 2021).
Чтобы понять на какой компонент сигнального пути действует THC, была исследована его способность ингибировать экспрессию Gli1 в эмбриональных фибробластах мыши (MEFs), мутантных по Ptch1 и Sufu. THC, в зависимости от дозы, ослаблял экспрессию Gli1 у фибробластов Ptch1−/−, но не у фибробластов Sufu−/−. Это значит, что THC изменяет интенсивность сигнала SHH для мишени, расположенной в каскаде ниже PTCH1, но выше SUFU. И такой мишенью является SMO.
Таким образом, в данной статье было показано, что THC является прямым ингибитором SMO и тератогеном при условии наличия генетического груза. Подчеркивается, что определение такой роли каннабиса в формировании дефектов эмбрионального развития поможет снизить риски их возникновения.
Авторы вышеприведенных исследований на примере сигнального пути HH показали, что генетические факторы и воздействия окружающей среды не суммируются, а взаимодействуют сложным и непредсказуемым образом. Например, влияние среды может “спасти” фенотип, обусловленный определенной мутацией. И наоборот, мутация может не проявляться в фенотипе вплоть до момента возникновения триггеров, которыми могут выступать условия окружающей среды.
Список литературы:
Kong, J. H., Siebold, C., & Rohatgi, R. (2019). Biochemical mechanisms of vertebrate hedgehog signaling. Development (Cambridge, England), 146(10), dev166892. https://doi.org/10.1242/dev.166892
Новость подготовили ©Гайдамака Анна, Каримова Марьяна
06.12.2021