doi: 10.3389/fimmu.2020.01016

 © Ненашева Татьяна Анатольевна, старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, кандидат биологических наук
© Ненашева Татьяна Анатольевна, старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, кандидат биологических наук
Макрофаги играют ключевую роль в поддержании тканевого гомеостаза, участвуя в регуляции иммунного ответа на воздействие травматического или инфекционного агента, процессе фагоцитоза патогенов и поврежденных собственных клеток, регенерации тканей. Поскольку нарушение функции макрофагов вовлечено в патофизиологию целого ряда опухолевых, нейродегенеративных и сердечно-сосудистых заболеваний, эти клетки представляют собой привлекательную мишень для терапевтического воздействия. Разработка клеточной терапии, ориентированной на макрофаги, требует глубокого понимания их биологии и иммунологических свойств.
Резидентные макрофаги (TRMs) выполняют свои функции локально в тканях различных органов. Долгое время считалось, что источником этих клеточных популяций служат циркулирующие в организме моноциты крови, которые мигрируют из кровеносного русла и созревают непосредственно в ткани. Серия недавних экспериментальных исследований поставила под сомнение эту концепцию, продемонстрировав, что резидентные макрофаги развиваются из эмбриональных предшественников, которые заселяют ткани во время эмбрионального и раннего постэмбрионального периодов. В настоящее время TRMs рассматривают как дифференцированные долгоживущие клетки, способные к пролиферации и самообновлению. Другая точка зрения состоит в том, что в постэмбриональном периоде моноциты крови участвуют в поддержании пула тканевых макрофагов. В частности, в желудочно-кишечном тракте, коже и сердце эмбриональные макрофаги с возрастом заменяются клетками, происходящими из циркулирующих моноцитов; в других случаях миграции моноцитов крови в органы и ткани способствует воспаление.
Для изучения биологии макрофагов человека обычно используют клетки, полученные из моноцитов крови человека (MDM), которые лишь частично могут моделировать TRMs. В ответ на потребность в адекватной модели для исследований in vitro, в последние годы разработаны методы поэтапной дифференцировки макрофагов из индуцированных плюрипотентных стволовых клеток (иПСК). В данной работе iMφ были получены из иПСК человека с помощью протокола, который предполагает несколько последовательных этапов: образование эмбриоидных телец (EB), гемопоэтическая дифференцировка моноцитоподобных клеток в присутствии IL-3 и M-CSF и окончательное созревание макрофагов под влиянием M-CSF.
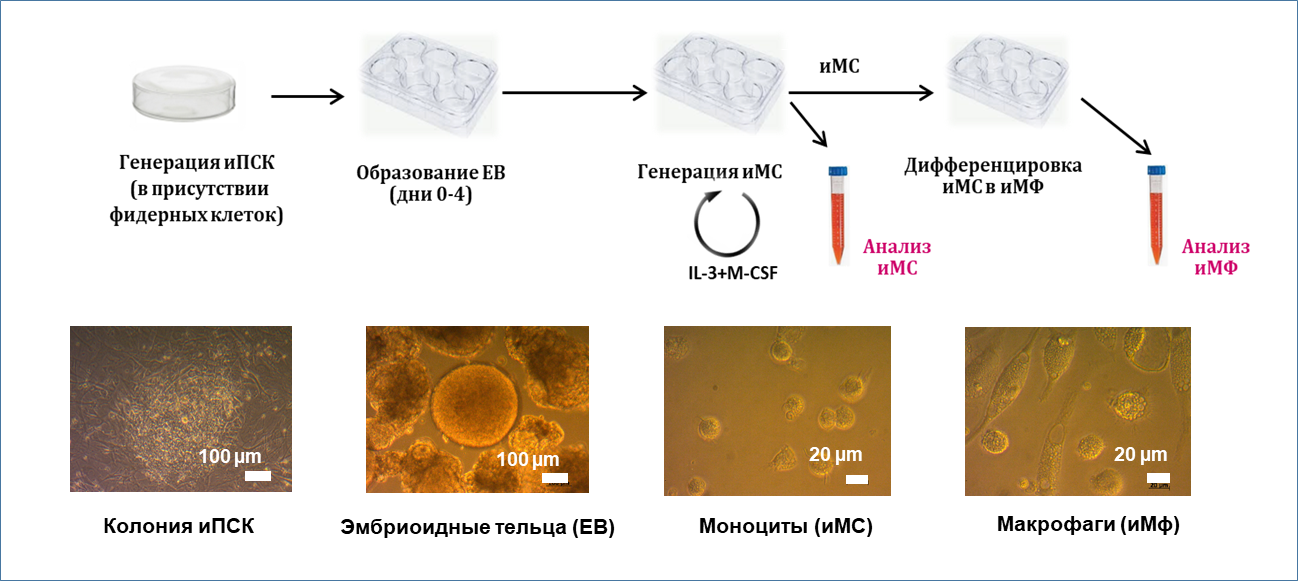
Рис. 1.
В настоящем исследовании мы стремились охарактеризовать фенотипические, секреторные и антибактериальные свойства полученных из иПСК моноцитов/макрофагов (iMC/iMφ) в сравнении с клетками, существующими in vivo: моноцитами периферической крови и дифференцированными из них макрофагами (MC/MDM), а также макрофагами легочной ткани (TB-Mφ).
Согласно результатам фенотипического анализа, iMφs:
- экспрессировали лейкоцитарные (CD45) и миелоидные маркеры (CD11b, CD64), маркеры зрелых макрофагов (CD16, CD195);
- имели фенотип CD14+ CD16dim;
- демонстрировали неполяризованный или слегка смещенный в сторону противовоспалительного фенотип. Последнее следует из более высокого уровня экспрессии CD163 и CD206 по сравнению с CD80 и CD86, активации CD163 и CD206 (но не CD80 и CD86) в процессе дифференцировки iMC в iMφ.;
- имели низкую экспрессию HLA-DR.
Специфический паттерн экспрессии поверхностных маркеров, отображаемый iMφ, полученных из линии иПСК IMA, был подтвержден с использованием iMφ из другой клеточной линии иПСК – KYOU.
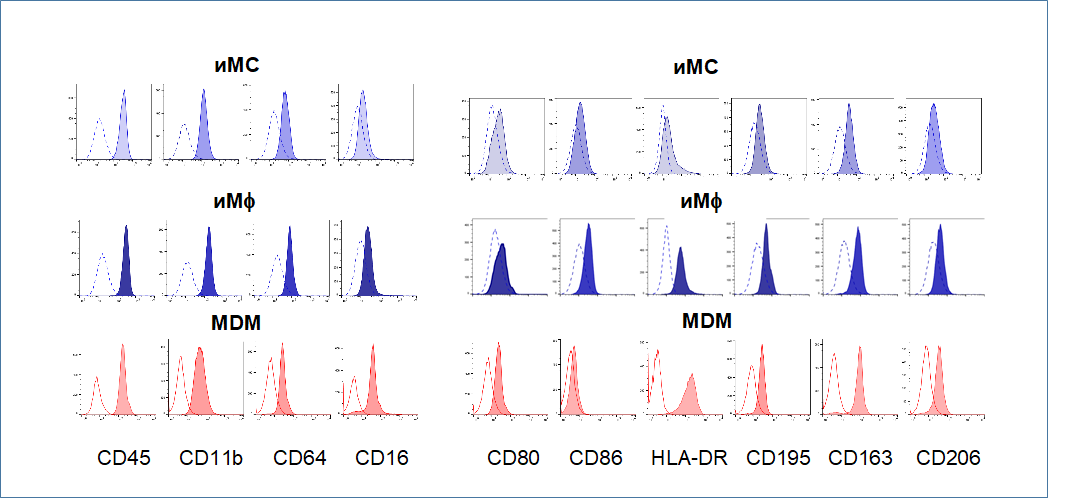
Рис. 2.
MDM были представлены в основном субпопуляцией CD14+CD16+ с небольшой долей клеток CD14+CD16–. iMC и iMφ, напротив, визуализировались единой популяцией CD14+CD16dim, которая отличалась от MDM более низким уровнем экспрессии CD16. Эти данные указывают на сходство iMφ с эмбриональными макрофагами, которые согласно литературным данным, дифференцируются в CD14+CD16+, не проходя через стадию CD14+CD16-.
В целом, фенотипический анализ выявил как сходные характеристики iMφ и MDM, так и некоторые их различия. Различная экспрессия некоторых маркеров (например, CD11b, CD86), вероятно, была связана с индивидуальными вариациями клеток, полученных от генетически разных доноров. Однако, низкий уровень экспрессии HLA-DR и паттерн ко-экспрессии CD14/CD16, по-видимому, отражают характерные особенности iMφ.
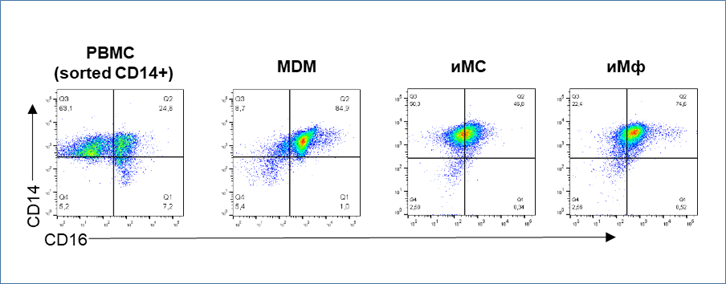
Рис. 3.
Для проведения сравнительного фенотипического анализа iMφ и резидентных макрофагов легких мы использовали образцы легочной ткани, полученные при хирургическом лечении больных туберкулезом. Биоптаты гомогенизировали для приготовления клеточных суспензий и анализировали фенотип популяции CD14+ клеток. У тех же больных производили забор периферической крови и выделение моноцитов для сравнительного анализа.
В отличие от моноцитов крови, которые содержали субпопуляции клеток CD16+ и CD16–, макрофаги из ТБ-легких были гомогенны по содержанию CD16, а также экспрессировали CD11b на более низком и CD206 на более высоком уровне. В свою очередь, iMφ демонстрировали общие фенотипические черты с макрофагами, изолированными из ТБ-легких (в отношении CD16, CD11b и CD206).
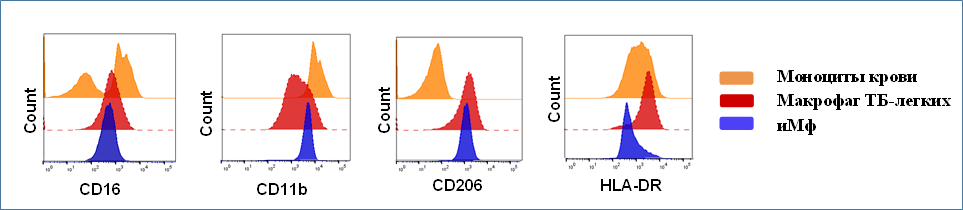
Рис. 4.
Наблюдаемая более высокая экспрессия HLA-DR макрофагами легких и моноцитами крови в сравнении с iMφ, вероятно, связана с тем, что эти клетки были получены из инфицированных Mtb тканей и имели активированный статус. Стоит отметить, что культивированные в отсутствие воспалительного микроокружения, iMφ отличались и от моноцитов крови здоровых доноров. Это, по-видимому, объясняется тем, что in vivo даже у здоровых людей циркулирующие моноциты подвергаются воздействию различных стимулов (например, цитокинов и других растворимых факторов).
На следующем этапе был проанализирован секреторный профиль iMφ и МDM. Супернатанты клеточных культур содержали как про-воспалительные, так и противовоспалительные цитокины. Однако, IL-1β и IL-12 (IL-12p40 и IL12-p70), два основных про-воспалительных фактора, связанных с M1 поляризацией макрофагов, детектировались на очень низком уровне, а соотношение IL-10/IL12p70 составило >20. Это согласуется с неполяризованным / низкополяризованным фенотипом iMφ, и объединяет макрофаги, полученные из иПСК, с эмбриональными макрофагами и резидентными макрофагами in vivo.
Рядом недавних исследований продемонстрировано, что ассоциированные с легкими макрофаги фенотипически и функционально неоднородны. iMφ, полученные в нашем эксперименте, напоминали популяцию интерстициальных макрофагов, о чем свидетельствовали: высокая степень вакуолизации, крупный размер клеток, CD206+ фенотип, низкий уровень экспрессии MHC класса II, секреция про- и противовоспалительных цитокинов.
MDM, полученные из моноцитов крови здоровых доноров, обладали большей секреторной активностью, чем iMφ, что также свидетельствует о более высоком уровне активации клеток.
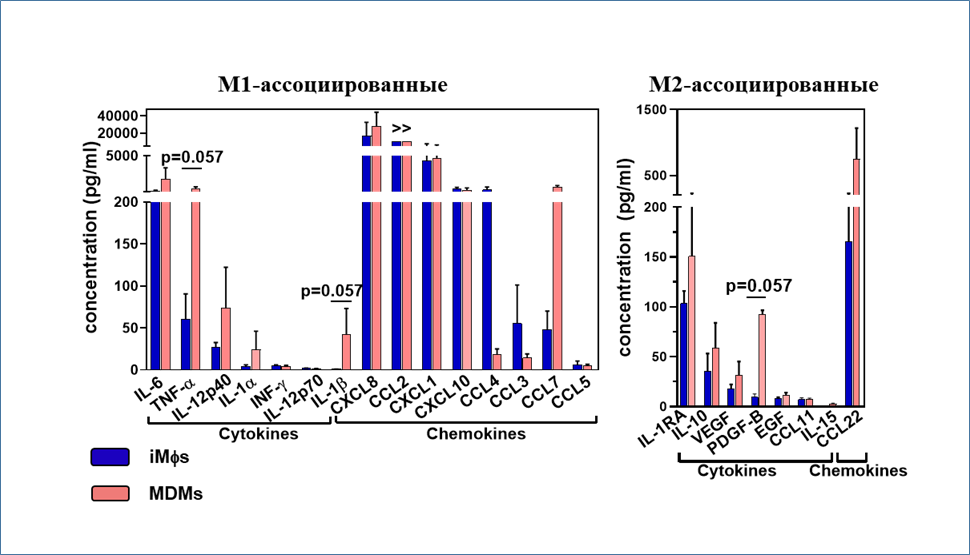
Рис. 5.
iMφ легко меняли свой фенотип и секреторный профиль в ответ на воздействие воспалительных факторов. При стимуляции клеточных культур LPS или LPS+IFNγ, повышалась экспрессия HLA-DR, многократно возрастала продукция TNF-α. Вместе с другими нашими наблюдениями это говорит о том, что iMϕ представляют адекватную модель для анализа функционирования «наивных» макрофагов при попадании в воспалительную среду.
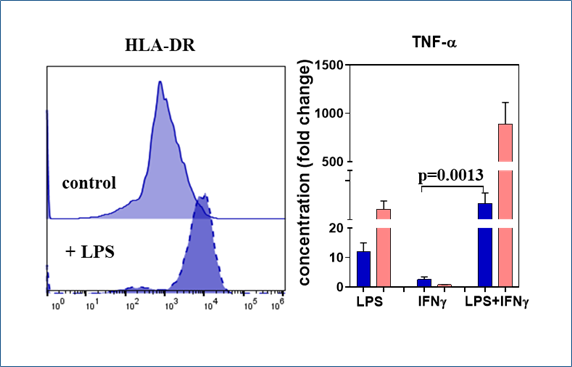
Рис. 6.
В литературе представлены данные о фагоцитарной активности макрофагов, полученных из иПСК, в отношении микрогранул, меченых флуорофорами, и бактерий. Однако, способность iMφ ограничивать рост бактерий остается недостаточно изученной.
В наших экспериментах более 80% iMφ поглощали меченые флуоресцентным маркером E. coli. Чтобы изучить антибактериальную способность iMφ, мы культивировали их с живыми микобактериями. Рост Mtb был оценен с помощью анализа поглощения [3H]-урацила и путем прямого количественного определения КОЕ микобактерий, оставшихся после культивирования с макрофагами. В обоих экспериментах iMφ ингибировали рост микобактерий более, чем на 75%.
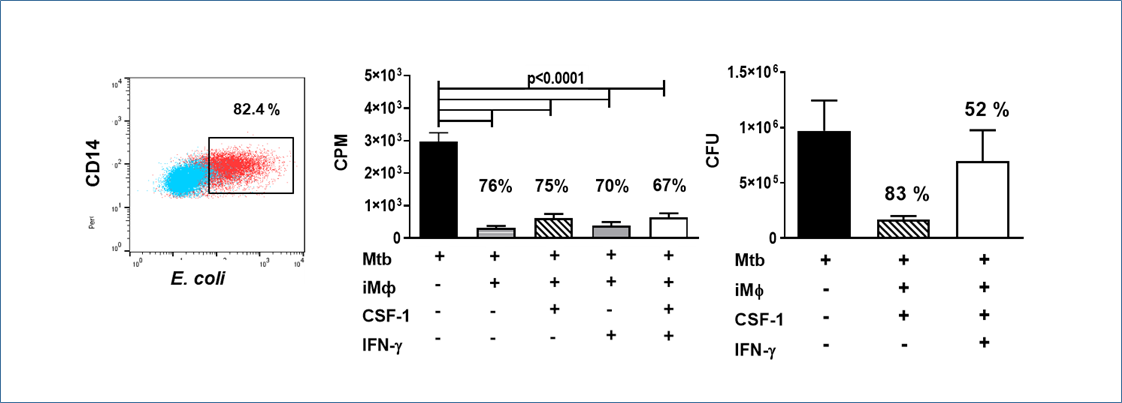
Рис. 7.
Таким образом, iMφ фагоцитируют микобактерии и способны ограничивать бактериальный рост in vitro.
Полученные нами результаты характеризуют макрофаги, полученные из иПСК человека, как дифференцированные, малоактивированные / малополяризованные фагоциты, обладающие функциональной активностью и проявляющие антибактериальные свойства. iMφ отличаются от моноцитов крови, сравнимы с макрофагами моноцитарного происхождения и тканевыми макрофагами легких. Подробная фенотипическая и функциональная характеристика iMφ, проведенная в данном исследовании, позволяет утверждать, что макрофаги, дифференцированные из индуцированных плюрипотентных клеток человека, представляют собой перспективную платформу для изучения иммунологии тканевых макрофагов, в том числе взаимодействий с инфекционными агентами. Исследования продолжаются.
Работа поддержана грантом Российского научного фонда № 19-75-20176 (iMφ-дифференцировка, экспансия, функциональные анализы, фенотипические исследования, анализ клеток крови; выполнено в ИБР РАН) и программой Российской академии наук «Фундаментальные исследования для биомедицинской технологии (экспериментальная разработка процедуры дифференцировки; выполнено в ЦНИИТ). Получение иПСК и начальные этапы их дифференцировки проведена в ИЦИГ СО РАН и РНИМУ.
Новость подготовили © Ненашева Т.А., Герасимова Т.П.
06.10.2020