© Калабушева Екатерина Павловна, с.н.с. лаборатории клеточной биологии ИБР РАН;
© Калабушева Екатерина Павловна, с.н.с. лаборатории клеточной биологии ИБР РАН;
Ульянов Сергей Владимирович, с.н.с. лаборатории структурно-функциональной организации хромосом ИБГ
Ответ – нет! По крайней мере именно это доказали ученые из Шанхая в своей работе, опубликованной в журнале Cell Discovery, принадлежащем группе Nature, и обладающим импакт-фактором WoS 10,849. Секрет публикации отрицательных результатов в качественном исследовании и хорошо выстроенной доказательной базе. Давайте же с ним ознакомимся.
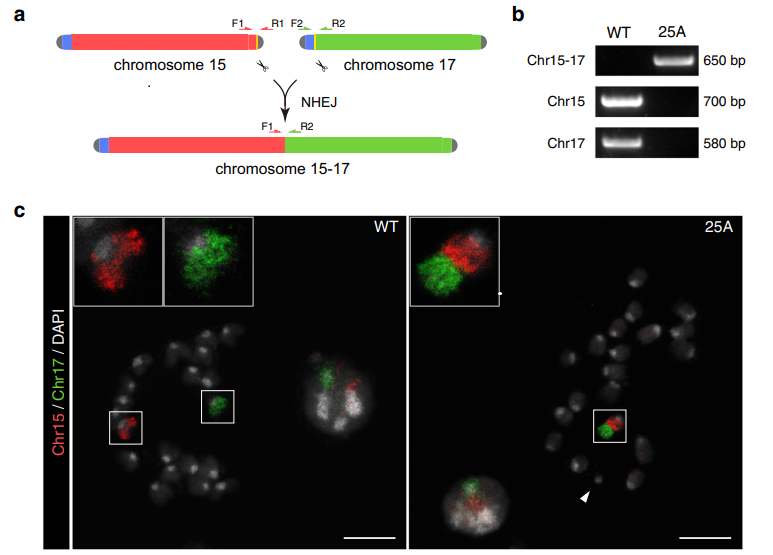
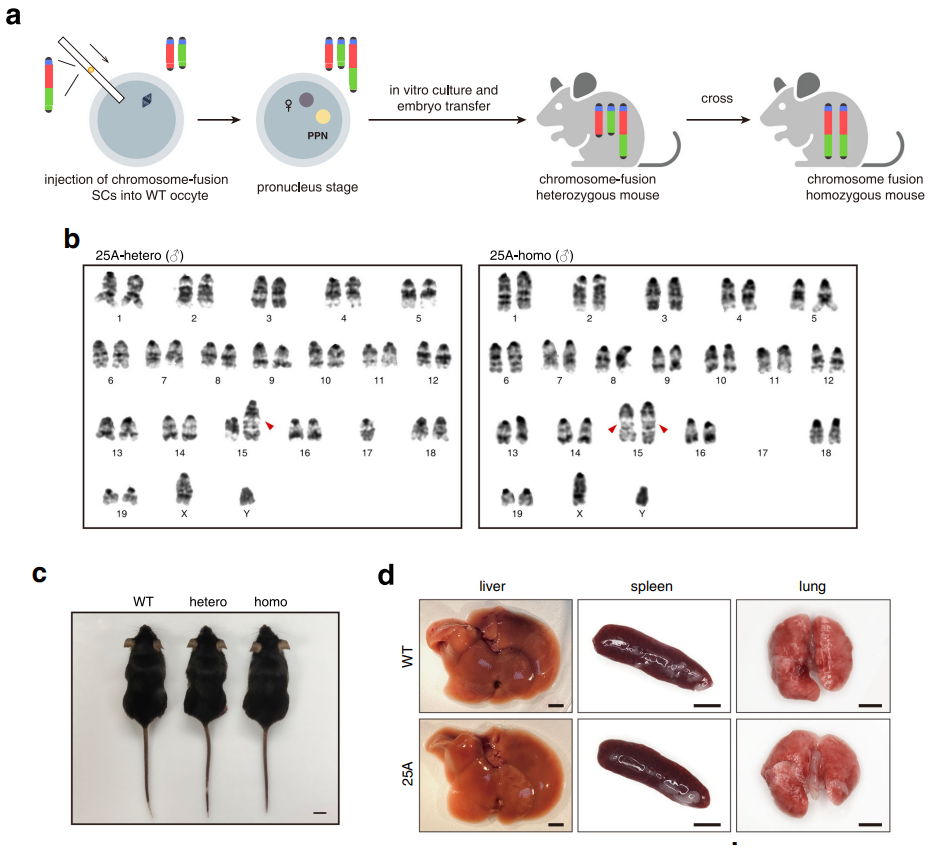
Исследователи задались вопросом – насколько важны хромосомные территории. Только во время клеточного деления хромосома находится в конденсированном состоянии, в интерфазе же деконденсированный хроматин занимает определенную позицию в клеточном ядре, которая называется хромосомной территорией. Расположение хромосомных территорий воспроизводится внутри одного клеточного типа. Чтобы изменить расположение хромосом, авторы работы решили слить 2 хромосомы в одну. Применяя CRISPR-Cas9, они сделали фьюжн хромосом 15 и 17 (рис.1а). Выбор на эти хромосомы пал поскольку они являются телецентрическими, то есть центромера смещена к одному из концов хромосомы, а также рядом с центромерой отсутствуют гены, которые можно случайно утратить при объединении хромосом. ПЦР (рис.1b) и FISH (рис.1с) показали, что слияние хромосом прошло успешно.
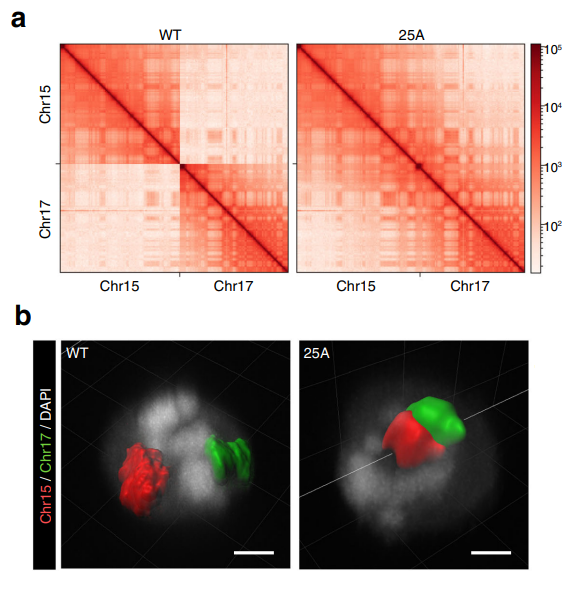
Анализ изменения хромосомных территорий можно проводить несколькими способами. Например, методом Hi-C исследовали частоту контактов между разными хромосомами. Конечно же наиболее сильные изменения затронули хромосомы 15 и 17, частота контактов между ними увеличилась при слиянии (рис.2а). Результаты 3D-FISH показали, что в клетках дикого типа хромосомы находились значительно ближе к границам ядра, однако при слиянии они сместились в центр (рис.2b). Эти изменения повлекли за собой перемещение других хромосом: хромосома 9 сместилась к внешнему краю, в то время как 12 и 16 мигрировали в сторону центра.
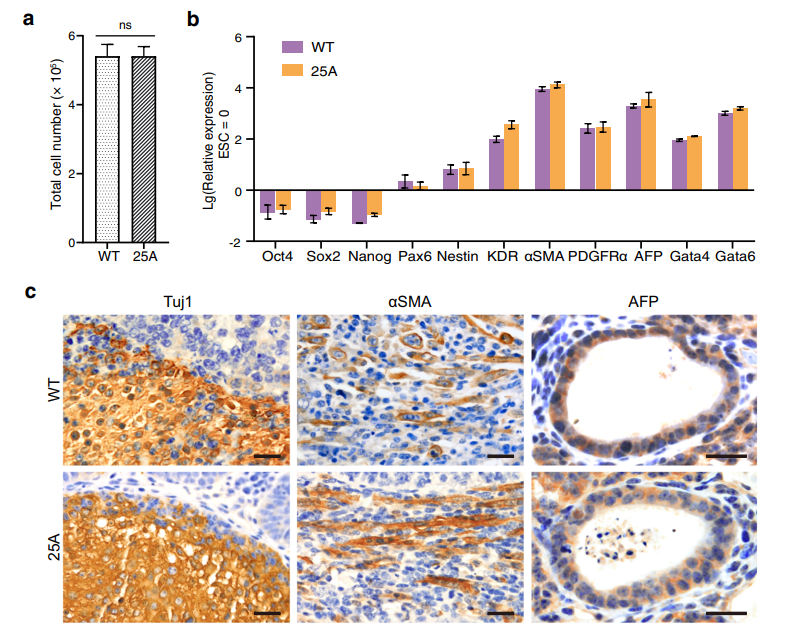
Подтвердив изменения хромосомных территорий, исследователи оценили, как это сказывается на экспрессии различных белков и поведении клеток в целом. В работе использовали эмбриональные стволовые клетки мыши, которые являются плюрипотентными. Изменение хромосомных территорий не оказало статистически значимого эффекта ни на скорость роста клеток (рис.3а), ни на экспрессию специализированных маркеров плюрипотентности (рис. 3b) и способности дифференцироваться по 3-м классическим направлениям (рис. 3с). При глобальном анализе экспрессии выявили, что только для 0,33% от всех генов существуют статистически значимые изменения, из которых 94,8% менее чем в 2 раза (рис.3, d,e). К тому же анализ не выявил корреляции между этими изменениями и перестройками хромосомных территорий.
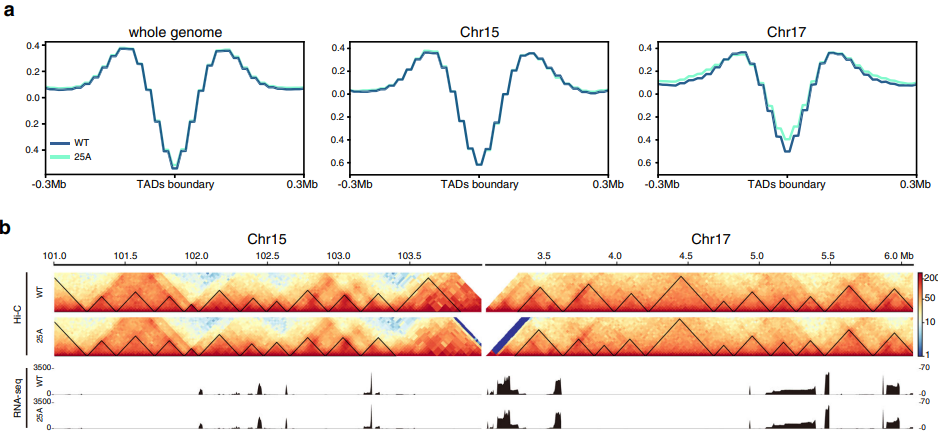
Исследователи решили посмотреть глубже и оценили, как хромосомные перестройки влияют на структуру топологически-ассоциированных доменов хроматина. Такие структуры считают единицами контроля регуляции экспрессии генов в хроматине. Анализ не показал значительных изменений и на уровне топологически-ассоциированных доменов (рис.4). Таким образом исследователи подтвердили, что изменение хромосомных территорий не оказывает влияния на профиль экспрессии.
Исследователи решили не ограничиваться только клеточными линиями, и получили мышей, имеющих слитые хромосомы 15 и 17 (рис.5). Мутантные мыши внешне не отличались от контрольных, а также не имели дефектов в тканях и органах. Мутация наследовалась по типичному менделевскому расщеплению. Таким образом, результаты работы in vivo подтвердили результаты in vitro.
Что мы знаем из других исследований? В работе по объединению 4 и 5 хромосом мыши также не обнаружили влияния на клеточную плюрипотентность или ранний эмбриогенез, в то время как при фьюжне 1 и 2 хромосом возникали проблемы при митозе (Wang et al, 2022). Хромосомы 1 и 2 являются самыми крупными у мыши, поэтому нарушения клеточного деления имели механическую природу. Объединение целых 16-и хромосом в клетках дрожжей в одну также не приводило к значительным изменениям в транскриптомном профиле (Shao et al, 2018). Результаты этих исследований также указывают на отсутствие прямой зависимости транскрипции определенных генов от локализации хромосом в ядре.
На положение хромосом влияет множество факторов – от типа клеток и размера самих хромосом (у теплокровных большие хромосомы как правило находятся ближе к ядерной оболочке) до взаимодействий хроматина с различными ядерными структурами. Так, неактивные районы генома контактируют с ядерной ламиной – белковой «сеткой», изнутри подстилающей ядерную мембрану. Иммунофлуоресцентная окраска хроматина и компьютерное моделирование показывают, что разрушение ядерной ламины ведёт к смещению хроматиновой массы ближе к центру ядра и разрыхлению тех хроматиновых глобул, которые контактировали с ламиной наиболее плотно (Ulianov et al, 2019). Эти данные показывают, что положение хромосом в ядре является следствием характеристики хроматина внутри хромосомы, в частности его транскрипционной активности. Тем не менее нельзя исключать возможность того, что ключевые эксперименты в этой научной сфере пока не проведены, и исследования безусловно должны продолжаться.
Список цитируемой литературы:
1. Wang Y, Qu Z, Fang Y, Chen Y, Peng J, Song J, Li J, Shi J, Zhou JQ, Zhao Y. Chromosome territory reorganization through artificial chromosome fusion is compatible with cell fate determination and mouse development. Cell Discov. 2023 Jan 24;9(1):11. doi: 10.1038/s41421-022-00511-1. PMID: 36693846; PMCID: PMC9873915.
2. Wang LB, Li ZK, Wang LY, Xu K, Ji TT, Mao YH, Ma SN, Liu T, Tu CF, Zhao Q, Fan XN, Liu C, Wang LY, Shu YJ, Yang N, Zhou Q, Li W. A sustainable mouse karyotype created by programmed chromosome fusion. Science. 2022 Aug 26;377(6609):967-975. doi: 10.1126/science.abm1964. Epub 2022 Aug 25. PMID: 36007034.
3. Shao Y, Lu N, Wu Z, Cai C, Wang S, Zhang LL, Zhou F, Xiao S, Liu L, Zeng X, Zheng H, Yang C, Zhao Z, Zhao G, Zhou JQ, Xue X, Qin Z. Creating a functional single-chromosome yeast. Nature. 2018 Aug;560(7718):331-335. doi: 10.1038/s41586-018-0382-x. Epub 2018 Aug 1. PMID: 30069045.
4. Ulianov SV, Doronin SA, Khrameeva EE, Kos PI, Luzhin AV, Starikov SS, Galitsyna AA, Nenasheva VV, Ilyin AA, Flyamer IM, Mikhaleva EA, Logacheva MD, Gelfand MS, Chertovich AV, Gavrilov AA, Razin SV, Shevelyov YY. Nuclear lamina integrity is required for proper spatial organization of chromatin in Drosophila. Nat Commun. 2019 Mar 12;10(1):1176. doi: 10.1038/s41467-019-09185-y. PMID: 30862957; PMCID: PMC6414625.
Новость подготовили
© Калабушева Е.П., Ульянов С.В.
06.03.2023