Jorstad N.L., Wilken M.S., Grimes W.N., Wohl S.G., Vanden Bosch L.S., Yoshimatsu T., Wong R.O., Rieke F., Reh T.A. Stimulation of functional neuronal regeneration from Müller glia in adult mice. Nature. 2017. V. 548. P. 103–107
Zhao C., Tao Z., Xue L., Zeng Y., Wang Y., Xu H., Yin ZQ. Lin28b stimulates the reprogramming of rat Müller glia to retinal progenitors. Exp Cell Res. 2017. V. 1. N 352(1). P.164-174.
 © Григорян Элеонора Норайровна
зав. лабораторией проблем регенерации. д.б.н. Область научных интересов: клеточные и молекулярные механизмы регенерации органов и тканей у позвоночных животных.
© Григорян Элеонора Норайровна
зав. лабораторией проблем регенерации. д.б.н. Область научных интересов: клеточные и молекулярные механизмы регенерации органов и тканей у позвоночных животных.
Накопившиеся за последние 15 лет данные, говорят о том, что сетчатка глаза позвоночных обладает несколькими популяциями клеток с нейрогенным потенциалом, что открывает новые возможности для регенерационной медицины. В настоящее время наиболее активно сразу несколькими лабораториями мира изучаются биология и поведение глиальных клеток Мюллера, макроглии (MG) в сетчатке глаз позвоночных - от рыб до млекопитающих. Эти клетки были известны раньше как источник роста и восстановления сетчатки у некоторых видов рыб, а также птиц до и сразу после вылупления. У высших позвоночных в ответ на повреждение эти клетки демонстрируют реактивный глиоз, пролиферируя, увеличивая свою популяцию и размеры проходящего через всю толщу внутренней сетчатки длинных отростков этих клеток.
Клетки MG высоко специализированы, выполняют структурную и трофическую функции, включены в систему очистки сетчатки и световосприятия, обладают большим числом связей со всеми типами нейронов сетчатки. У рыб при росте глаза они поддерживают линию фоторецепторов (палочек); при регенерации способны дать популяцию предшественников для фоторецепторов, биполяров и ганглиозных клеток (Lenkowski, Raymond, 2014). При этом происходит ассиметричный митоз, появляется в дальнейшем амплифицирующая клетка - предшественник. Ее потомки, смещаясь радиально, дифференцируются в нейроны. У птиц после вылупления можно также наблюдать регенерационную активность MG in vivo, но при стимуляции MG с помощью IGF и RA (Fisher et al., 2002). Эти и другие данные позволили рассматривать клетки Мюллера как наиболее перспективный эндогенный источник регенерации в сетчатке высших позвоночных и человека.
Многого удалось достичь в направлении репрограммирования клеток Мюллера в системах in vitro. Так, Reh и соавторы в культурах диссоциированных глиальных клеток с помощью вирусов впервые обеспечили доставку транскрипционного фактора Ascl1, играющего роль в нейрональной дифференцировке (Pollak et al., 2013). Инфицированные клетки теряли свою исходную морфологию, экспрессировали гены нейральных предшественников, а также пан-нейральные маркерные белки, а в дальнейшем и белки специфической нейрональной дифференцировки. Удалось выяснить также, что up-регуляция гена Lin28b может активировать репрограммирование клеток Мюллера (Zhao et al., 2017). Ueki et al., 2015 также удалось репрограммировать клетки MG в нейральном направлении, но только у совсем молодых мышей, чья сетчатка была повреждена NMDA (N-methyl-d-aspartate) и облучением избыточным светом. В этой модели репрограммирование происходило также в ответ на сверх экспрессию инфецированного гена Ascl1. Эти и другие работы подготовили почву для направленного экспериментирования in vivo на поврежденной сетчатке взрослых мышей.
В 2017 году в журнале Nature была опубликована статья «Stimulation of functional neuronal regeneration from Müller glia in adult mice». Авторам из четырех институтов в США удалось у зрелых мышей, у которых нейрогенный потенциал исчерпан и не выявляется даже в условиях сверх экспрессии Ascl1 (а это происходит уже на 16 сутки постнатального развития) добиться регенеративного ответа со стороны клеток MG. Предполагалось, что такая зависимость от возраста связана с потерей доступа Ascl1 к хроматину, т.е. с неким, ассоциированным с возрастом эпигенетическим фактором, в конечном итоге лимитирующим регенерацию. Дальнейшие выяснения вопроса привели к заключению, что у взрослых мышей наряду с повреждением сетчатки со сверх экспрессией Ascl1 должен быть применен ингибитор деацетилазы гистонов. Ингибитор деацетилазы гистонов увеличивает доступ к ключевым участкам генов клеток MG, тем самым способствуя репрограммированию. В этом случае клетки потомки MG могли не только экспрессировать спектр маркерных белков внутренней сетчатки, но и формировать новые синапсы с предсуществующими нейронами и отвечать на стимуляцию светом. Представленная работа убедительно показала, что для активации репрограммирования эндогенных клеток предшественников для регенерации сетчатки in vivo у млекопитающих необходим спектр условий - от повреждения ее структуры, увеличения экспрессии ряда генов до регуляции эпигенетического состояния клеток. Понимание спектра этих условий, а также условий безопасности их применения, может позволить трансляцию подхода в медицину с целью борьбы с дегенеративными заболеваниями сетчатки, со слепотой.
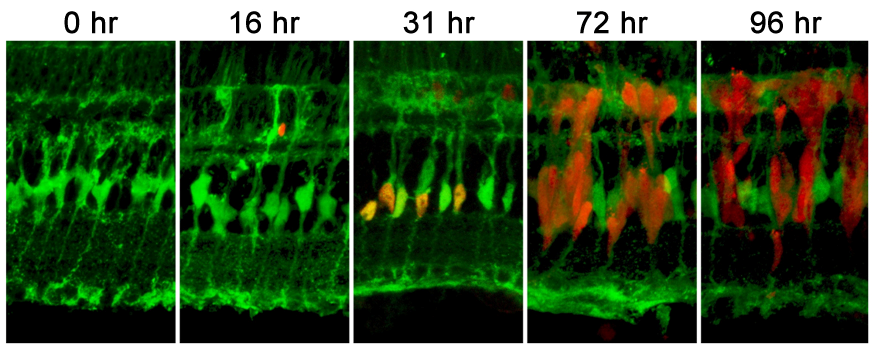
Рисунок. Клетки Мюллера являются источником клеток предшественников для регенерации сетчатки взрослых позвоночных животных. Срезы взяты от трансгенных рыб (gfap:EGFP) с зеленой меткой. Красная метка - экспрессия PCNA в клетках предшественниках регенерации сетчатки в разные сроки (hr) после повреждения. Иллюминация интенсивным светом приводит к гибели фоторецепторов и вхождению клеток Мюллера в клеточный цикл. Потомки этих клеток продолжают пролиферировать, мигрируют в фоторецепторный слой сетчатки и замещают погибшие фоторецепторы. Иллюстрация со страницы Thummel lab (Detroit, USA)
Ссылки:
Fischer AJ., McGuire CR, Dierks BD., Reh T.A. Insulin and fibroblast growth factor 2 activate a neurogenic program in Müller glia of the chicken retina. J. Neurosci. 2002. V.1. N 22(21). P.9387-9398.
Lenkowski J.R., Raymond P.A. Müller glia: Stem cells for generation and regeneration of retinal neurons in teleost fish. Prog. Retin. Eye Res. 2014. V. 0: 94–123.
Pollak J., Wilken M.S., Ueki Y., Cox K.E., Sullivan J.M., Taylor R.J., Levine, E.M., Reh, T.A. ASCL1 reprograms mouse Muller glia into neurogenic retinal progenitors. Development. 2013. V. 140. P. 2619–2631.
Ueki Y., Wilken MS., Cox KE., Chipman L., Jorstad N., Sternhagen K., Simic M., Ullom K., Nakafuku M., Reh TA. Transgenic expression of the proneural transcription factor Ascl1 in Müller glia stimulates retinal regeneration in young mice. Proc Natl Acad Sci U S A. 2015. 112. V. 44. P.13717-13722.
Новость подготовила © 2018 Григорян Э.Н.
06.03.2018