 © Куликов Алексей Михайлович,
© Куликов Алексей Михайлович,
зав. лабораторией эволюционной генетики развития. д.б.н., зам. директора ИБР по научной работе. Область научных интересов: механизмы эволюции на ранних этапах дивергенции видов.
Технологии. Инструмент, созданный наукой и предназначенный для решения практических задач, определяющих все аспекты нашей жизни - от бытовых проблем до научного познания окружающего мира. Умберто Эко в статье "Наука, технология и магия" писал о двойственности восприятия технологий, обеспечивающих "мгновенный результат" и маскирующих ту длинную цепочку научных открытий, которая и привела к формированию той или иной технологии. От такого мистического ощущения "внезапности" и всемогущества технологий тяжело избавиться даже профессионалам, особенно в области биологии, где сплав физики, химии, математики и инженерии на наших глазах породили удивительный набор возможностей научного анализа природных явлений и сущностей. И, тем не менее, стремительное развитие биотехнологий закономерно связано с уровнем развития научных направлений и практическим интересом общества к целям и задачам, декларируемым этими направлениями. Статья американской научной журналистки Эстер Ландхуис посвящена наиболее значимым в ближайшей перспективе технологиям, применяемым в прорывных направлениях биологии, и построена как серия коротких интервью со специалистами, представляющими эти направления.
Ван Хонг Вэй, специалист в области структурной биологии из Университета Цинхуа, рассказывает о применении трансмиссионной криогенной электронной микроскопии (cryo-EM) для анализа структуры макромолекул в их естественном окружении, т.е в «контексте клетки». Быстрое замораживание образцов предотвращает их обезвоживание, критичное для поддержания трехмерной структуры белков, нуклеиновых кислот и более сложных комплексов, как в момент подготовки препарата, так и при обработке пучком электронов в ходе анализа образца. Для предотвращения разрушения структур, оказывающихся на границе сред, их фиксируют на двумерных поверхностях, например, на углеродной решетке графена. Значительное улучшение качества изображений должно снизить на три порядка их количество, необходимое для восстановления структуры молекулы, и значительно ускорить анализ механизмов развития патологий и взаимодействия лекарство – мишень.
Сара Вудсон, биофизик из Университета Джона Хопкинса, участвует в разработке методов визуализации биогенеза РНК в клетке. Сочетая разные методы секвенирования РНК, короткие и длинные чтения, можно определить как варианты модификации РНК, так и их пространственную и временную динамику. Используя аптамеры, флюоресцирующие одноцепочечные молекулы нуклеиновых кислот, безошибочно связывающиеся со своими мишенями и чувствительные к их структуре, удается проследить за созреванием, фолдированием, модификациями, перемещениями РНК в клетке, образованием комплексов с белками в режиме реального времени. В конечном итоге, это позволяет соотнести биогенез РНК и клеточные процессы.
О задачах анализа микробиома и методах работы с ним рассказывает Эльханан Боренстейн, профессор вычислительной системной биологии из Университета Тель-Авива. Огромное поливидовое сообщество микроорганизмов, населяющее различные органы и ткани человека, во многом определяет состояние здоровья носителя. И критическую роль в этом играют вырабатываемые разными видами бактерий метаболиты, посредством которых они общаются между собой и вступают во взаимодействие с организмом (геномом) хозяина. Анализ механизмов взаимодействий хозяин – микробиом является комплексной многоуровневой задачей. Технология анализа этих взаимодействий, применяемая в лаборатории профессора Боренстейна, заключается в моделировании влияния на общий метаболом каждого конкретного вида бактерий в составе микробиоты, исходя из данных индивидуального анализа генома и метаболома данного вида. Прогностические модели, учитывающие совокупное влияние всех членов микробного сообщества на метаболом, сравниваются с реальными данными, и используются для формирования алгоритма анализа первичных данных. Можно ожидать, что данные такого анализа будут востребованы для восстановления оптимального состава микробиома в каждом индивидуальном случае.
Объем накопленных знаний позволяет все чаще использовать моделирование биологических процессов в клетках и сообществах клеток, и использовать симуляции процессов для сравнения с эмпирическими данными и поиска наиболее характерных параметров изучаемых процессов и их маркеров. Кристина Куртис, системный биолог из Стэндфордского Университета, использует в своих исследованиях закономерностей развития злокачественной опухоли математическое моделирование роста опухоли с учетом ее тканевой структуры, гетерогенности, клеточности и с имитацией паттерна мутаций конкретного пациента. Дополняя имитационные данные в экспериментальных исследованиях данными прямых наблюдений, с применением ДНК-штрихкодирования на основе CRISPR, удается проследить динамику трансформации клеток опухоли, метастазирование и топологическое распределение клеток в самой опухоли, связать их генотип, жизнеспособность и вклад в развитие опухоли.
Алекс Норд, генетик из Калифорнийского Университета из Девиса, рассказывает о современных технологиях профилирования энхансеров, специфичных для контроля экспрессии генов в определенных тканях и органах. Значительное развитие получили исследования регуляции экспрессии генов в нейронах различных областей мозга, использующие доставку генно-инженерных вирусов, способных проникать через гематоэнцефалический барьер, и несущих тестируемые последовательности энхансеров и репортерный ген флуоресцирующего белка. Специфичные для разных классов нейронов энхансеры были получены, используя сочетание нескольких технологий – секвенирования библиотек РНК из одиночных ядер (snRNA-Seq), секвенирования транспозаза-доступных участков генома из одиночных ядер (ATAC-seq) и биоинформатический анализ эволюционной консервативности выделенных последовательностей и их обогащенности мутациями, связанными с дисфункциями нейронов. Для контроля активности тканеспецифичных энхансеров генов, например в случае дисфункции, вызванной делецией одной из копий гена на сестринской хромосоме, предлагается амплифицировать соответствующий энхансер в рабочей копии гена, применяя технологии геномного редактирования CRISPR-Cas9. Эксперименты на животных моделях показали успешное применение таких подходов при генетически детерминированных синдромах ожирения, хрупкой Х-хромосомы, синдромах Ретта и Драве.
Кристофер Лав из Института комплексных исследований рака им. Коха в Массачусетском технологическом институте в Кембридже, использует технологию РНК-секвенирования одиночных клеток для определения подтипов Т-лимфоцитов с разными ролями и антигенной специфичностью. Хотя Кристофер отмечает, что полученное разрешение оценок экспрессионного профиля клеток пока недостаточно высокое, разработаны методы для выявления транскриптов с низким уровнем экспрессии и протоколы определения связи профиля экспрессии и специфичности Т-клеточного рецептора. Наконец, разработан протокол подготовки образца к хранению и сам метод хранения в микропланшете в составе массива лунок для индивидуальных клеток, что делает доступным молекулярное профилирование любого образца из любой точки мира.
Технологии определения связи структуры и функции генома обсуждает Дженнифер Филлипс-Креминс, специалист по эпигенетике и биоинженерии из Университета Пенсильвании в Филадельфии. Используя метод CRISPR-GO, или «генетический пинцет», исследователи переносят исследуемый локус ДНК в разные участки ядра и определяют, как пространственное размещение локуса влияет на экспрессию генов, локализованных в нем. Этот метод основан на лиганд-опосредованной димеризации CRISPR-dCas9 комплекса (с лишенными нуклеазной активности белками CAS) c белками различных ядерных компартментов. Еще один метод – активированной светом динамической петли (LADL), использует входящие в состав комплекса CRISPR молекулы РНК в качестве направляющих. Их пространственная колокализация обеспечена посредством индуцированной синим светом гетеродимеризации криптохрома-2 и химерного белка dCas9-CIBN. Программируемые таким образом перестройки трехмерной организации хроматина в интерфазном ядре приводят к разным вариантам пространственной колокализации промотеров и дистантно удаленных энхансеров. Корреляция экспрессионной активности маркерного гена и пространственного совмещения его промотора с дистантными энхансерами является подтверждением функциональной связи этих элементов. Третья система определения связи структуры и функции генома использует CRISPR-dCas9-опосредованную технологию формирования «ядерных конденсатов» - областей, разделенных фазовым переходом нуклеоплазмы, связанным с разницей в насыщенности раствора неупорядоченными белками. Такие конденсаты выталкивают нити ДНК за пределы области с повышенной концентрацией белков. CRISPR-dCas9-комплекс содержит направляющую РНК, обеспечивающую связь с целевым участком ДНК, и активатор SunTag – полипептидный массив, привлекающий множество антител. Использование антител к неупорядоченным белкам как раз и приводит к формированию «пузыря конденсата», в области которого останется только локус, связанный со специфичным комплексом CRISPR-dCas9. Использование нескольких таких комплексов приводит к слиянию пузырей конденсатов и топологическому сближению локусов из разных частей генома. Совмещение этих 3D-геномно-инженерных технологий с CRISPR-опосредованными подходами визуализации процессов в ядре живой клетки позволит наблюдать связь структурных и функциональных изменений в режиме реального времени.

Рис 1. Activated T cells from human blood.
Рис 2. Priorities for the next 10 years of human microbiome research
Рис 3. The virus SH1, reconstructed from images obtained using cryogenic electron microscopy.Credit: Luigi De Colibus/University of Oxford
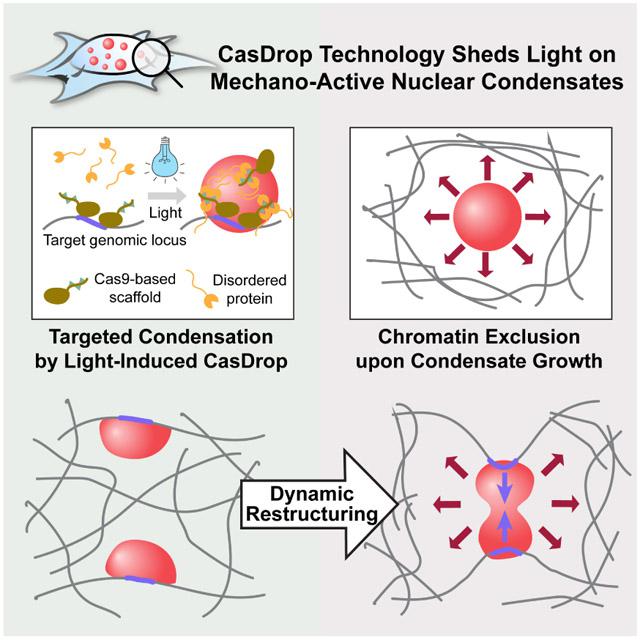
Рис 4. Пояснения в тексте.
Новость подготовил © 2020 Куликов А.М.
06.02.2020