 © Симонова Ольга Борисовна
- руководитель лаборатории РЕГУЛЯЦИИ МОРФОГЕНЕЗА, кандидат биологических наук.
© Симонова Ольга Борисовна
- руководитель лаборатории РЕГУЛЯЦИИ МОРФОГЕНЕЗА, кандидат биологических наук.
Группа ученых из Бирмингемского Университета показала участие эпигенетически модифицированной мРНК, N6-метиладенозин (m6A), в регуляции экспрессии генов, контролирующих определение пола плодовых мушек дрозофил.
|
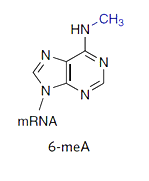
Модификация мРНК, называемая «m6A»: метилирование аденозина по азоту в позиции 6.
СПРАВКА. мРНК эукариот подвергаются посттранскрипционному метилированию. Наиболее распространённой модификацией является метилирование остатков аденозина по положению N6 с образованием N6-метиладенозина (m6A). Этот процесс катализируют ферменты N6-аденозинметилтрансферазы, которые распознают остатки аденозина в консенсусных последовательностях GAC (70 % случаев) и AAC (30 % случаев). Соответствующие деметилазы катализируют обратный процесс деметилирования. Учитывая обратимость и динамичность процесса метилирования мРНК, а также повышенную концентрацию m6A в длинных экзонах и вокруг стоп-кодонов, предположили, что метилирование мРНК выполняет регуляторную функцию. Одна из первых работ, выявляющая распространённость и динамичность эпигенетический модифицикации мРНК (m6A), это работа Wang et al., N6-methyladenosine-dependent regulation of messenger RNA stability. Nature. 2014. 505. p. 117-120.
Функция m6A, модифицикации мРНК, известной также как модификация «пятого нуклеотида» («fifth nucleotide», видимо, по аналогии с известным фильмом «Пятый элемент»), долгое время оставалось загадкой. Новое исследование, опубликованное недавно в «Nature», показало, что m6A играет ключевую роль в регуляции работы гена Sex-lethal (Sxl), который контролирует определение пола у дрозофилы. Sxl является «геном-переключателем», т.е. пол дрозофилы зависит от того, идёт или нет производство белка Sxl. Синтез мРНК Sxl происходит и у самцов, и у самок, но только мРНК самок может производить функциональный белок, подвергаясь полозависимому альтернативному сплайсингу, тогда как у пре-мРНК самцов не вырезается «мужской экзон» (третий), в котором расположен стоп-кодон UGA, не дающий образоваться полноценной мРНК, в результате чего синтезируется неактивный белок.
Альтернативный сплайсинг является широко распространенным механизмом экспрессии генов и характерен почти для всех человеческих генов, способствуя синтезу бОльшего разнообразия белков, чем можно было бы ожидать от 20000 белок-кодирующих генов в нашем геноме. Новое исследование учёных из Бирмингемского Университета показывает, что m6A контролирует этот процесс для гена Sxl у дрозофилы, в конечном счете, определяя путь развития мушки в сторону самца или самки. Они продемонстрировали, что отсутствие фермента Ime4 (Inducer of meiosis 4), осуществляющего метилирование m6A, подавляет специфичный для самок альтернативный сплайсинг гена Sxl, нарушая определение пола мушки. В результате рождаются жизнеспособные (в отличие от нокаута этого гена у растений и мышей), но нелетающие, подобные самцам особи. Результаты исследования проливают свет на понимание механизма широко изучаемого процесса определения пола на классическом объекте, коим является дрозофила.
Несмотря на то, что определение пола является фундаментальным процессом, у природы есть много способов для его осуществления. Исследование группы д-ра Соллера (Matthias Soller) показывает, что m6A-опосредованное регулирование экспрессии генов может быть древним пока еще неисследованным механизмом для создания такого разнообразия.
Интересно, что эта работа была выполнена в сотрудничестве с группой д-ра Руперта Фрая (Rupert Fray) из Ноттингемского Университета, сотрудники которой, работая на Arabidopsis, обнаружили, что фермент растения, необходимый для ввода модифицированного нуклеотида в мРНК, взаимодействует с белком, гомологичным фактору Female Lethal D (FL(2)D), определяющему пол у дрозофилы. По словам д-ра Соллера, открыть участие m6A в определении пола дрозофилы, можно было бы гораздо раньше, если бы не чувствительность генетических взаимодействий, нарушающих развитие самок.
Наконец, исследование Бирмингемских учёных показало, что активность белка Sxl, регулируемая через m6A, кроме определения пола, необходима также для старта дифференцировки герминативных стволовых клеток в оогенезе. Без этой регуляции, отсутствие экспрессии Sxl в стволовых клетках может привести к развитию рака яичников.
Обратимый характер метильной метки у m6A является новым уровнем регуляции экспрессии генов, получившим название "эпитранскриптомный". Это гарантирует проведение дальнейших исследований для установления связи эпитранскриптома с заболеваниями человека, например, такими, как рак.
Новость подготовила © 2016 Симонова О.Б.
05.12.2016