 © Дашинимаев Эрдэм Баирович,
старший научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
© Дашинимаев Эрдэм Баирович,
старший научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
21 октября 2019 в журнале Nature была опубликована научная статья «Search-and-replace genome editing without double-strand breaks or donorDNA» под авторством коллектива исследователей из университетов Кембриджа и Гарварда.
https://www.ncbi.nlm.nih.gov/pubmed/31634902
Данная статья посвящена новому методу редактирования генома эукариот, основанному на улучшении хорошо всем знакомой и широко используемой системы CRISPR/Cas9. Осмелюсь напомнить аудитории, что в классическом варианте это двухкомпонентная система, состоящая из белка-нуклеазы Cas9, которая создает разрыв в обоих цепях ДНК и короткой последовательности РНК (порядка 100п.н.), называемой гидовой РНК (или направляющей РНК), которая определяет место разрыва по принципу комплементарности (Рис.1).
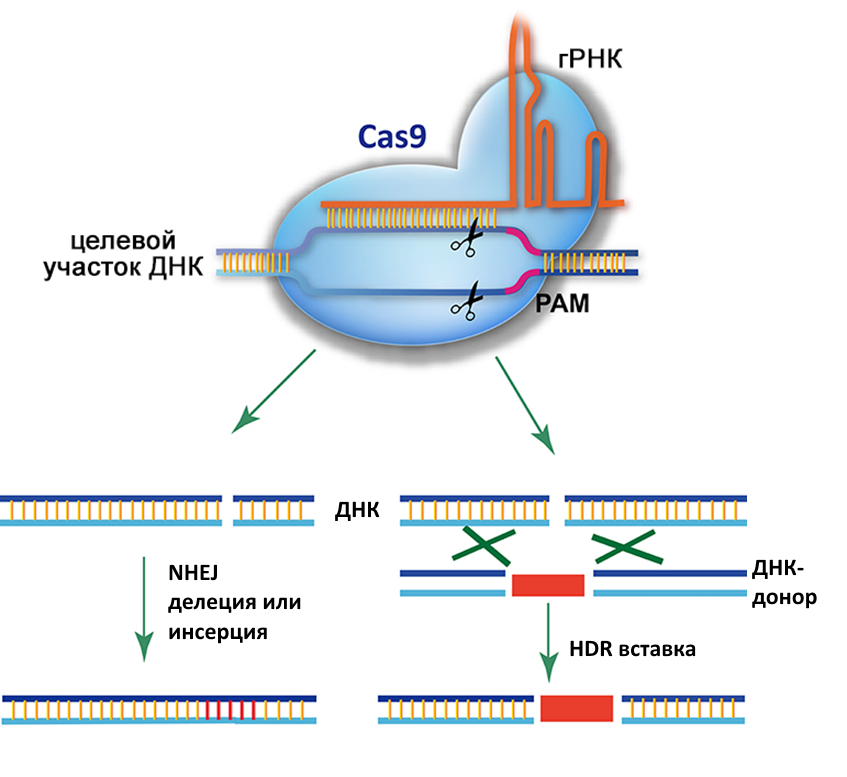
Рис.1. CRISPR/Cas9, NHEJ, HDR. ((по Y. Ding et al., 2016))
Данная система отлично себя зарекомендовала в клетках млекопитающих (в т.ч. человека) для создания нокаутирующих мутаций, поскольку после создания разрыва в необходимом месте геномной ДНК, клеточный комплекс репарации по типу негомологичного соединения концов (non-homologous end joining, NHEJ) может вносить ошибки в репарируемую ДНК (чаще всего короткие делеции 1-10п.н.) в зоне разрыва. Которые, уже могут привести к нокауту гена, если место разрыва было запланировано внутри белок-кодирующей последовательности гена. В этом качестве, система CRISPR/Cas9 работает эффективно, воспроизводимо и достаточно «легко» в том смысле, что такие эксперименты не требуют огромных усилий и ресурсов.
Однако, что касается целенаправленного редактирования генома, а именно целенаправленного изменения редактируемой последовательности ДНК, его буквальной записи в том самом виде, в котором мы хотим и никак иначе - здесь классический CRISPR/Cas9 показал себя не с самой лучшей стороны. Предполагается, что в этом случае для целенаправленной записи в геном необходимой последовательности, мы должны воспользоваться системой гомологичной репарации (Homology directed repair, HDR), которая используя т.н. ДНК-донор в качестве образца, запишет нужную последовательность. Для этого нужен ДНК-донор (используют как двухцепочечную ДНК в виде плазмид, так и одноцепочечную ДНК) содержащий плечи гомологии, которые должны фланкировать редактируемый участок слева и справа. Размеры таких гомологичных участков, варьируют в разных исследованиях, но в целом исследователи сходятся во мнении, что даже короткие плечи длиной 50-100п.н.вполне работают. Проблема данной стратегии заключается в том, что очень сложно совместить в одной точке пространства-времени несколько событий и факторов - разрыв ДНК, комплекс HDR и ДНК-Донор. А учитывая, что комплекс NHEJ конкурирует с HDR, и благодаря тому, что ему ДНК-донор как раз не требуется, то NHEJ обычно побеждает. Вследствие этого, обычно эффективность такого целенаправленного редактирования генома крайне низкая – порядка 1-5% в лучшем случае, при условии соблюдения практически идеальных условий эксперимента.
И вот, решив, что дальше так продолжаться не может, коллектив авторов рассматриваемой статьи задался решить эту проблему. Для этого они решили сконструировать химерный белок nCas9 (никаза, мутантный Cas9, у которого отключен один из двух активных центров, и который получил способность резать только одну цепь ДНК) с присоединенным ферментом ревертазой (т.е. РНК-зависимой ДНК полимеразой) от вируса MMLV. Также исследователи сконструировали химерную гидовую РНК (названную ими prime editing gRNA = pegRNA), состояющую из стандартной базовой гидовой РНК с присоединенной к 3’ концу матрицей для ревертазы. При этом на самом конце химерной гидовой РНК находится сайт, комплементарный (порядка 8-15 букв) участку разрезаемой цепи и который служит праймером для посадки ревертазы и начала синтеза цепи ДНК. Общая схема комплекса представлена на Рис.2.
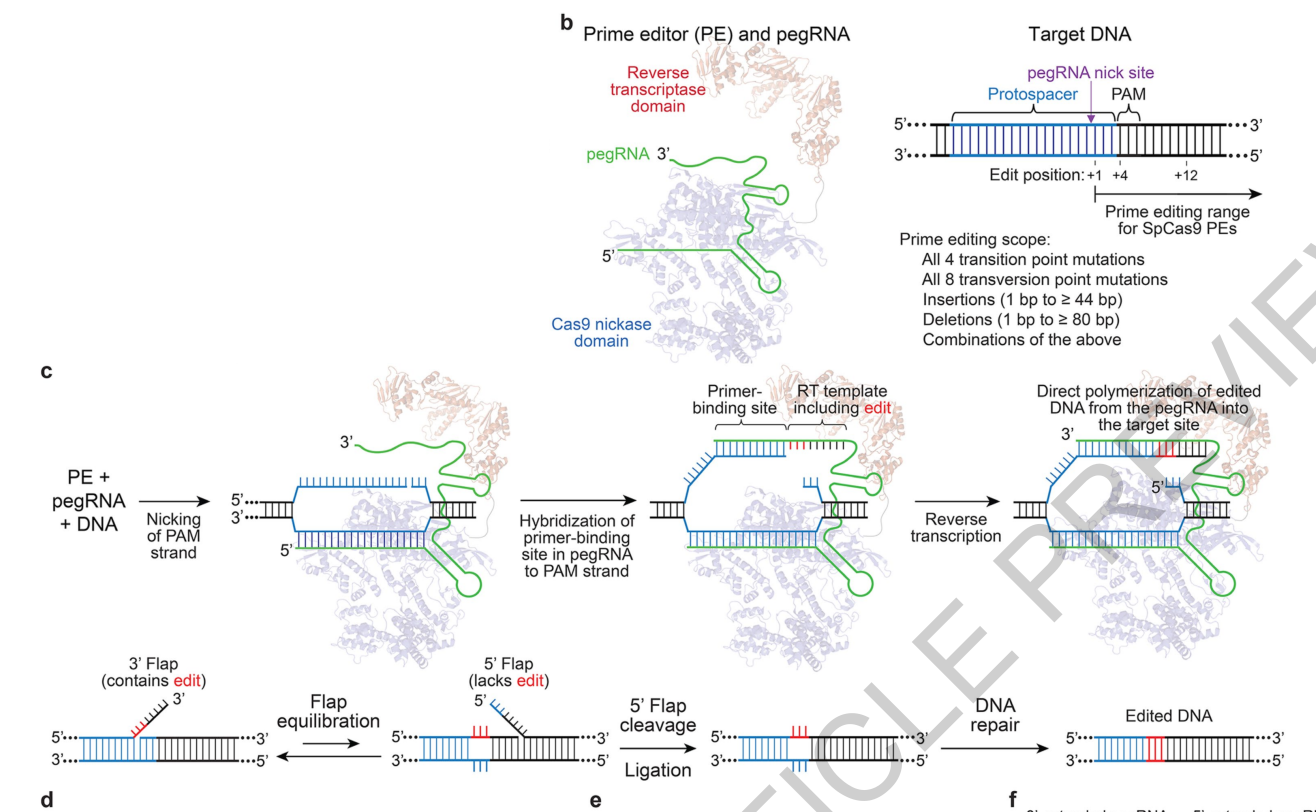
Рис.2. Общая схема PE (prime editing) комплекса (по Andrew V. Anzalone et al.2019).
Общая предполагаемая цепь событий при использовании этого хитрого комплекса такова:
- Весь комплекс связывается с необходимым участком геномной ДНК, после чего двойная цепь расплетается и никаза совершает разрыв цепи на которой находится PAM мотив. Нужно учесть, что редактируемый участок должен находится внутри узнающий последовательности pegRNA – это важно, об этом в конце.
- Свободный 3’ конец pegRNA с праймером на конце отжигается на порезанную цепь.
- Ревертаза достраивает цепь ДНК по предложенной матрице, в которой, как предполагается, находится нужная нам замена нуклеотидов. Достраивает, видимо, до некого «тупика», дальше которого ревертаза продвинуться не может из-за пространственно-структурных ограничений комплекса. Важно, чтобы на конце редактируемого и синтезируемого учатска также находились некие буквы гомологии со второй (целой) цепью.
- После этого комплекс сваливается с ДНК и система застывает в неустойчивом равновесии, когда возле одноцепочечного разрыва находятся два свободно-«болтающихся» конца ДНК, один из которых (новый) заканчивается на 3’ и содержит отредактированные буквы, а второй (старый) начинается с 5’ и НЕсодержит отредактированные буквы.
- Оба свободных конца конкурируют за вторую целую цепь, и конечно хотя «старый» конец более комплементарен ей чем «новый», и таким образом вроде бы должен побеждать, но из-за того, что 5’ конец ДНК более предпочитаемый субстрат для структурно-специфических эндонуклеаз типа FEN1 (которые таким образом удаляют фрагменты Оказаки в процессе репликаици ДНК), в конце-концов новой отредактированной цепи удается занять место старой цепи с образованием гетеродуплекса.
- Затем происходит лигирование разорванной цепи и репарация старой по принципу комплементарности, а редактированные буквы занимают свое «законное» место. Возникает вопрос, а почему система должна репарировать старую цепь по примеру новой, а не наоборот? Ответ заключается в том, что если это произойдет, вся история начнется заново с пункта №1 и так раз за разом, пока не произойдет обратное. Надо учесть, что после успешно проведенной репарации, комплекс перестает узнавать данное место, что обеспечивает выход из цикла.
Идея в целом проста до изящества, но конечно сделать в реальной жизни всю систему рабочей было гораздо сложнее, чем представить и произнести на словах. Этому в целом и посвящена статья.
Были опробованы разные способы присоединения праймера – 5’ и 3’ концу гидовой РНК, были опробованы разные линкеры между этими частями, работа комплекса была провалидирована in vitro на молекулах ДНК и на плазмидных конструкциях в клетках, причем сначала это была просто смесь всех компонент, а потом уже все в химерных «фьюз»-вариантах. Была изучена эффективность работы комплекса в зависимости от длины праймера и длины матрицы. Полученный таким образом PE (prime editing) комплекс получил название PE1, т.е. первого поколения, и был признан рабочим вариантом с удовлетворяющей эффективностью (4-17% на локусе HEK3 в клетках HEK293T) работы. Также авторы тут же, как говорится «не отходя от кассы», создали PE комплекс второго поколения (PE2), в котором применили новый, улучшенный вариант ревертазы MMLV, в который были внесены мутации для улучшения термостабильности, процессинга, ДНК-РНК связывания и уменьшения RNAaseH–активности (та которая режет РНК в дуплексах РНК-ДНК). Всего было протестировано 19 (!) различных вариантов новой ревертазы, после чего лучшим был признан вариант с пятью мутациями (увеличение эффективности по сравнению с PE1 в 1,3-3 раза) и система получила название PE2. Для увеличения эффективности работы системы был проведен следующий апгрейд системы до третьего поколения (PE3 и PE3b), в состав которой была введена обычная гидовая РНК для формирования ник-разреза на НЕредактированной цепи (Рис.3) в отдалении от редактируемого участка. Данный ник-разрез ПОСЛЕ события образования гетеродуплекса X’Y, обеспечивает то, что репарироваться будет именно НЕредактированая цепь, что должно значительно увеличить эффективность работы всей системы.
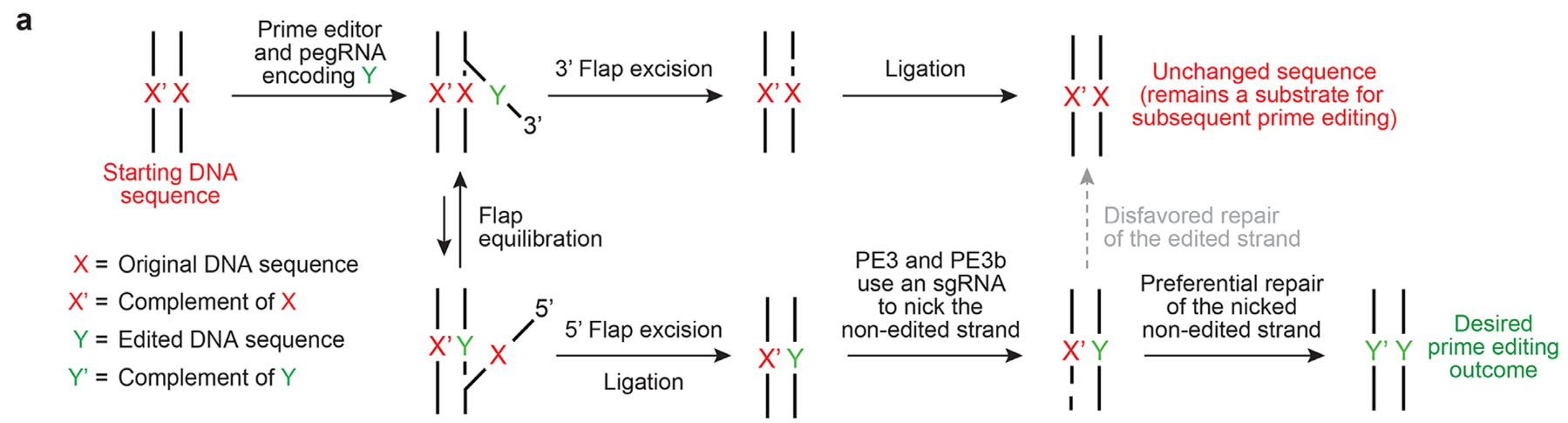
Рис. 3. Схема работы PE3 и PE3b комплекса (по Andrew V. Anzalone et al.2019).
Системы PE3 и PE3b отличаются друг от друга тем, что в случае PE3b гидовая РНК пишется прямо на место редактирования по уже отредактированной последовательности, для того, чтобы обеспечить возникновение ник-разрыва строго ПОСЛЕ события редактирования. После проведения всех тестов было показано, что общая эффективность работы PE3 и PE3b оказалась максимальной из всех наблюдаемых ранее, и составила порядка 30-40% для 1-3 нуклеотидных замен и инсерций, между собой же PE3 и PE3b не отличались по эффективности достоверно, но при этом система PE3b достоверно снижала количество возникающих нежелательных indel-мутаций.
В конце система была проверена на создании/исправлении известных человеческих мутаций, таких как HBB-E6V (в гене бета-глобина, серповидно-клеточная анемия) и HEXA 1278+TATC (в гене HEXA, болезнь Тея-Сакса), а также на трех дополнительных линиях клеток, кроме уже упомянутой HEK293T – на K562, U2OS, HeLa и на культуре кортикальных нейронов мыши. Везде система PE3 показала себя с лучшей стороны, с эффективностью редактирования от порядка 5% до 70% на разных мишенях и локусах.
Итак, чем же все это грозит нам, обычным рядовым труженикам дозаторов и пипеток? По всей видимости тем, что теперь уровень экспериментальных работ по редактированию генома с культурами клеток и другими биологическими объектами вырастет еще на одну ступень (если не на порядок), и конечно же нам необходимо будет освоить этот новый инструмент, чтобы по крайне мере попытаться соответствовать этому уровню. Современные проблемы требуют современных решений.
Многие из указанных в статье конструкций доступны на депозитории Addgene, любой желающий может купить их и попробовать сделать все самому:
http://www.addgene.org/browse/article/28206799/
Новость подготовил © Дашинимаев Э.Б.
31.10.2019