
Область научных интересов: протеомика, структура и функции белков, контроль клеточного протеома, связывающие белки, макромолекулярные комплексы в развитии, эволюция белков.
Развитие геномных и транскриптомных методов исследования, а также совершенствование биоинформатических подходов к анализу данных, полученных на эволюционно удаленных классах животных, принесли в последние десятилетия немало открытий в области молекулярных основ жизнедеятельности базальных животных. Так было установлено, что одна из самых ранних дивергентных филетических линий современных животных - губки (тип Porifera) возникли и развивались как сообщество разнообразных клеточных типов (Sogabe et al., 2019). Лишенные нервной системы губки в своем составе содержат клетки, у которых присутствуют все гены для выполнения нейрональных функций и реакции на ряд раздражителей (Musser et al., 2021). Геном губок кодирует большой репертуар рецепторов GPCR, связывающих G-белки, сходный по составу и структуре с другими многоклеточными животными, включая множество родопсин-GPCR-рецепторов (Rh-GPCR), организованных в геноме в кластеры, а сами губки также содержат их лиганды - метаботропный глутамат (mGluRs), ГАМК, адренергические вещества, серотонин, следовые амины (Krishnan et al. 2015; Goulty et al., 2023). Глутамат и ГАМК могут синтезироваться клетками губок. Серотонин и серотониноподобные молекулы, обнаруженные в губках, продуцируются их бактериальными симбионтами (Leys, 2015). Клетки губок сосуществуют с симбиотическими микробными сообществами, сложность и численность которых различаются в зависимости от вида (Steinert et al., 2020). Установлено, что способность оксида азота индуцировать заселение личинок морской губки кл. Demospongia Amphimedon queenslandica требует продукции его предшественника, аргинина, вырабатываемого горизонтально наследуемыми симбиотическими бактериями (Song et al., 2020), а три доминирующих симбионта - AqS1, AqS2 и AqS3, составляющие более 95% общей численности бактерий в личинках A. queenslandica, наследуются вертикально (Xiang et al., 2022).
В данной работе группа учёных из Австралии, впервые расшифровавших геном морской губки A. queenslandica, выяснила возможный химический способ передачи сигналов между царствами живых организмов, позволяющий холобионту и симбионтам общаться и регулировать физиологические состояния и развитие друг друга. В статье экспериментально установлено, что набор сигнальных молекул, которые функционируют как нейротрансмиттеры и нейромодуляторы у большинства животных с нервной системой, в частности дофамин и следовые амины (трейс-амины), производятся исключительно бактериальными симбионтами губки A. queenslandica. Авторами были реконструированы биосинтетические и сигнальные пути губки A. queenslandica и её симбионтов AqS1, AqS2 и AqS3 на основе аннотаций базы KEGG. Анализ AqS1, AqS2 и AqS3 геномов и генома A. queenslandica показал, что только симбионты AqS1 и AqS2 обладают способностью синтезировать дофамин, тирамин, триптамин, фенэтиламин и гистамин (Рис. 1). Дофамин может быть образован из тирозина путем окисления и декарбоксилирования соответственно полифенолоксидазой (PPO, EC 1.10.3.1) и декарбоксилазой ароматических L-аминокислот (AADC, EC 4.1.1.28). Тирамин, триптамин, фенэтиламин и гистамин образуются из тирозина, триптофана, фенилаланина и гистидина в результате катализа ферментом AADC. Гистидиндекарбоксилаза (HDC, EC 4.1.1.22) с большей вероятностью превращает гистидин в гистамин. В результате аннотирования путей метаболизма моноаминов и следовых аминов было установлено, что только тирозин может синтезироваться как в клетках губки-хозяина, так и её симбионтами (Рис. 1).
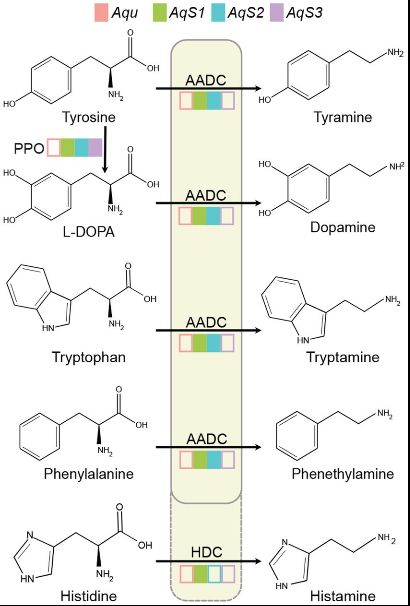
Рис. 1. Синтез тирамина, дофамина, триптамина, фенэтиламина и гистамина у холобионта A. queenslandica. Цветные прямоугольники указывают на наличие гена в геноме губок и трех видов бактериальных симбионтов. Транскрипты всех генов обнаружены у взрослой губки (Xiang et al., 2022). Пустые цветные прямоугольники означают, что ген не обнаружен в геноме губки. Aqu - геном A. queenslandica; AqS1, AqS2 и AqS3 - геномы симбионтов (Xiang et al., 2022). AADC, декарбоксилаза ароматических L- аминокислот (EC 4.1.1.28); HDC, гистидиндекарбоксилаза (EC 4.1.1.22); L-DOPA, L-3,4- дигидроксифенилаланин; PPO, полифенолоксидаза (EC 1.10.3.1).
Авторы выяснили какие именно GPCR-рецепторы имеются в геноме губки и симбионтах и определили их гомологию с рецепторами высших животных. Для анализа были использованы ранее опубликованные ими данные RNA-Seq отдельных клеточных типов (NCBI PRJNA258388, PRJNA694780, PRJNA412708 и PRJNA435744). В геноме Aqu2.1. были обнаружены 130 предполагаемых генов рецепторов родопсина Rh-GPCR (Fernandez-Valverde et al., 2015), два гена предположительно дофаминоподобных рецепторов, AquDRD1- подобный (Aqu2.1.30477) и AquDRD5-подобный (Aqu2.1.23882), которые похожи соответственно на D1-подобный рецептор позвоночных и дрозофилы и D5 позвоночных, а также единственный предполагаемый рецептор следовых аминов подобный AquTAAR (Aqu2.1.16444), который имеет гомологию с несколькими подтипами TAAR- рецепторов позвоночных. Филогенетический анализ указывает, что эти специфичные для A. queenslandica рецепторы близки к рецепторам родопсина Rh-GPCR. Ген AquDRD1-подобного рецептора (Aqu2.1.30477) кодирует семь трансмебранных (ТМ) доменов, причем седьмой домен предсказан на основе гидрофобности и топологии С- концевой области. Ген AquDRD5-подобного рецептора (Aqu2.1.23882) кодирует только пять TM доменов, но обладает признаками дофаминовых рецепторов: Asp в TM3, два Ser в TM5 и сайт N-гликозилирования на N-конце. Ген AquTAAR-подобного рецептора (Aqu2.1.16444) кодирует семь TM доменов и имеет структуру, наиболее сходную с семейством TAAR-подобных рецепторов высших животных.
Гены AquDRD1-, AquDRD5- и AquTAAR-подобных рецепторов экспрессируются дифференциально в процессе развития и в клетках взрослых губок, причем ген AquDRD1 – экспрессируется на высоком уровне, а гены AquDRD5- и AquTAAR-подобных рецепторов экспрессируются на низком уровне и только на определенных стадиях развития. AquDRD1-подобный рецептор экспрессируется на протяжении всего эмбриогенеза и метаморфоза, а также у личинок, молодых и взрослых особей. Этот ген экспрессируется одинаково на протяжении большей части развития, при этом число транскриптов временно увеличивается в начале метаморфоза - через 1 ч после расселения (hps) и у постличинок, когда начинают формироваться хоаноцитные камеры. У взрослых особей AquDRD1-подобный рецептор экспрессируется в большинстве типов клеток, однако наиболее высокий уровень экспрессии наблюдается в археоцитах, тогда как AquTAAR-подобный рецептор в археоцитах экспрессируется слабо. У личинок экспрессия AquDRD1 также обнаружена в разных типах клеток, и наибольшая экспрессия наблюдалась в клетках заднего пигментного кольца (полюса) личинок, которые играют важную роль в направленном плавании личинок.
Функциональную роль GPCR-рецепторов и нейромедиаторов в поведении губок авторы оценивали по фототаксису – изменению плавательного поведения личинок губок в ответ на световой градиент. Сначала авторы выяснили на какой стадии развития у личинок наиболее выражен отрицательный фототаксис. В опытах использовали личинок через 1–2, 4–6 и 10–12 ч после выхода из родительской губки (hpe), которых помещали в светлом конце камеры со световым градиентом, от светлого сектора Q1 до темного сектора Q4. Личинки опытной группы 4–6 hpe показали значительно более высокий уровень отрицательного фототаксиса по сравнению с группами 1–2 и 10–12 hpe. Большинство (93%) личинок группы 4–6 hpe уплывали в темный сектор камеры Q4 в течение 20–25 с после размещения на светлом конце камеры. Личинки, помещенные в сектор Q4, не уплывали из него, а затемнение камеры не вызывало направленного движения личинок. Далее авторы попытались выяснить участвуют ли дофамин и следовые амины, потенциально происходящие из вертикально унаследованных бактериальных симбионтов, в реализации отрицательного фототаксиса у личинок. Для этого сравнили плавательное поведение и уровень фототаксиса у контрольных личинок и личинок, подвергшихся воздействию ряда известных агонистов DRD-рецепторов или антагонистов TAAR-рецепторов у билатеральных животных. Опыты проводили на личинках 4–6 hpe, которые наиболее чувствительны к световым раздражителям, содержат вертикально унаследованных бактериальных симбионтов, а также экспрессируют все три гена предполагаемых рецепторов в клетках задней части личинки и в полюсном пигментном кольце. Личинок губок перед тестированием инкубировали в течение 3 мин с известными агонистами или антагонистами DRD- и TAAR-подобных рецепторов. Оказалось, что агонисты и антагонисты AquDRD1-, AquDRD5- и AquTAAR-подобных рецепторов достоверно увеличивают время, проведённое личинками в светлом отсеке (Рис. 2). Эти агонисты и антагонисты значительно ослабляют способность личинок уплывать от света, что свидетельствует о способности губок реагировать на дофамин и следовые амины. Влияние как агонистов, так и антагонистов дофамина на фототаксис заметно слабее, чем у трех следовых аминов, фенэтиламина, тирамина и триптамина, а также общего TAAR- агониста D,L-метанефрина (Рис. 2). Эти результаты показывают, что рецепторы в клетках пигментного кольца более чувствительны к следовым аминам, чем к дофамину. В качестве контроля авторы подвергли личинок воздействию двух следовых аминов с наиболее сильным эффектом, фенэтиламину и тирамину, а затем отмыли личинки от реагентов и повторно подвергли воздействию градиентом света. Эти личинки имели нормальный отрицательный фототаксис. Таким образом, следовые амины действительно взаимодействуют с рецепторами, поскольку их отмывка нивелирует эффекты агонистов. Относительно низкий уровень экспрессии генов AquDRD5- и AquTAAR-подобных рецепторов типичен для функциональных GPCR других животных, а более высокая экспрессия AquDRD1-подобного рецептора в клетках пигментного кольца предполагает возможную передачу сигналов именно через этот рецептор. К сожалению, в статье не показана экспрессия DRD- и TAAR-подобных рецепторов губки и симбионтов на белковом уровне, не выявлены их биохимические параметры, не учитывалось содержание эндогенных моноаминов и трэйс-аминов, влияющих на функциональное состояние рецепторов. Однако, модификация стереотипного плавательного поведения в условиях агонистов и антагонистов свидетельствует о том, что клетки губки-хозяина способны реагировать на бактериальные метаболиты - дофамин и следовые амины.
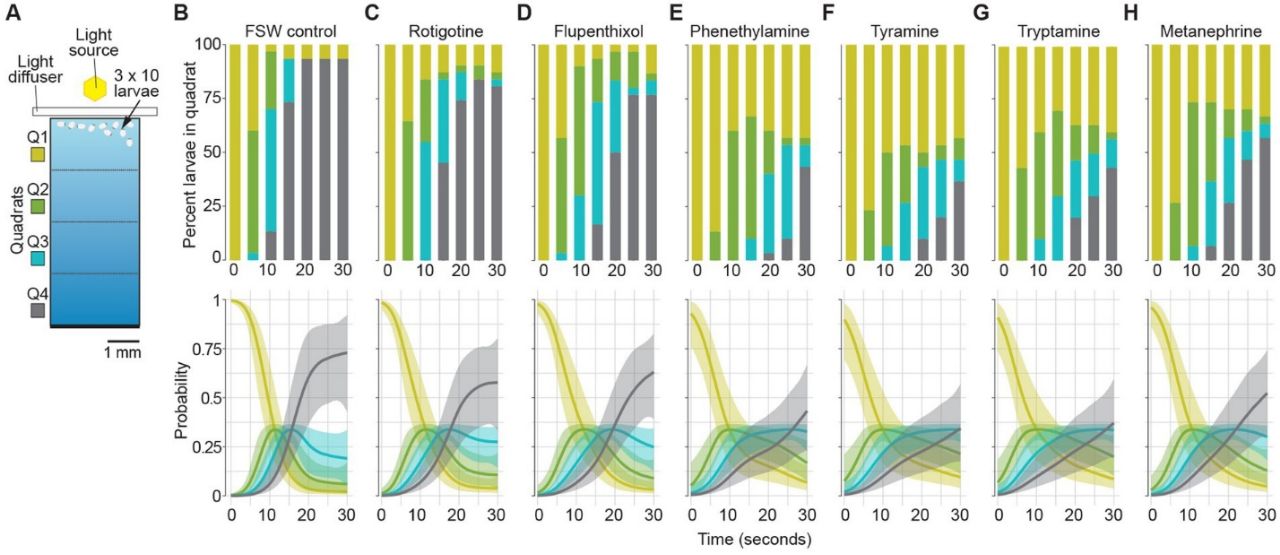
Рис. 2. Влияние агонистов и антагонистов дофамина и следовых аминов на фототаксис личинок. (A) Схема камеры Q1-Q4 для анализа фототаксиса личинок. Эксперимент проводился в трёх повторах, в каждом из которых использовали по10 личинок, загруженных в Q1 (светлый сектор). Перед помещением в аналитическую камеру с градиентом света личинки инкубировались в течение 3 мин в фильтрованной морской воде с агонистом или антагонистом. (B–H) Верхние графики: процент личинок, присутствующих в каждом секторе (Q1–Q4) для данной выборки каждые 5 секунд в течение 30 секунд наблюдения. Нижние графики: вероятность обнаружения личинок в квадратах для каждой выборки. Заштрихованные области соответствуют порогу 95% достоверности. (B) Положительный контроль при добавлении воды (FSW). (C) Агонист DRD рецепторов (10 мкМ ротиготина гидрохлорида). (D) Антагонист DRD рецепторов (10 мкМ дигидрохлорид флупентиксола). (E-F) Следовые амины и агонисты TAAR (100 мкМ): (E) фенэтиламина, (F) тирамин и (G) триптамин. (H) Неспецифический агонист TAAR (100 мкМ гидрохлорид D, L-метанефрина).
Таким образом, авторами статьи продемонстрировано участие дофамина и следовых аминов бактериального происхождения в модуляции поведения личинок губки A. queenslandica через Rh-GPCR-рецепторы и сопряженные пути, что указывает на то, что эти известные нейротрансмиттеры и нейромодуляторы могут быть регуляторными сигналами даже у животного без нейронов. Передача сигналов между царствами живых организмов могла возникнуть как результат древней системы обнаружения внеклеточных сигналов врожденной иммунной системой, которая позволяет различать симбионтов и чужеродные патогены. Происхождение врожденного иммунитета и системы передачи нейрональных сигналов, возможно, относится к ранним многоклеточным животным, которые использовали ассоциированные бактерии для регуляции своего развития. Современные животные, по-видимому, имели общего предка с сенсорными клетками и комплексом межклеточной сигнализации для адаптации к изменяющимся условиям окружающей среды. Этот предок существовал в симбиотических отношениях с микробами, как холобионт, и обладал способностью к эндогенному способу передачи сигналов между различными царствами живых организмов. Химические сигналы, которые используются в нервных синапсах, могли также использоваться донервными животными до расхождения гребневиков, губок и плакозойных. У человека и высших животных бактерии в кишечнике также производят метаболиты, нейротрансмиттеры и нейромодуляторы, которые могут влиять на нервную, эндокринную и иммунную системы хозяина, используя молекулярные механизмы, освоенные ещё базальными животными.
Дальнейшие исследования роли нейротрансмиттеров и нейромодуляторов в механизмах адаптации у донервных животных будут очень перспективными!
Список литературы:
- Sogabe, S., Hatleberg, W. L., Kocot, K. M., Say, T. E., Stoupin, D., Roper, K. E., et al. (2019). Pluripotency and the origin of animal multicellularity. Nature 570, 519–522. doi: 10.1038/s41586-019-1290-4
- Musser, J. M., Schippers, K. J., Nickel, M., Mizzon, G., Kohn, A. B., Pape, C., et al. (2021). Profiling cellular diversity in sponges informs animal cell type and nervous system evolution. Science 374, 717–723. doi: 10.1126/science.abj2949
- Krishnan, A., Dnyansagar, R., Almen, M. S., Williams, M. J., Fredriksson, R., Manoj, N., et al. (2015). The GPCR repertoire in the demosponge Amphimedon queenslandica: insights into the GPCR system at the early divergence of animals. BMC Evol. Biol. 14, 270–216. doi: 10.1186/s12862-014-0270-4
- Goulty, M., Botton-Amiot, G., Rosato, E., Sprecher, S. G., and Feuda, R. (2023). The monoaminergic system is a bilaterian innovation. Nat. Commun. 14:3284. doi: 10.1038/ s41467-023-39030-2 4. Leys, S. P. (2015). Elements of a “nervous system” in sponges. J. Exp. Biol. 218, 581–591. doi: 10.1242/jeb.110817
- Steinert, G., Busch, K., Bayer, K., Kodami, S., Arbizu, P. M., Kelly, M., et al. (2020). Compositional and quantitative insights into bacterial and archaeal communities of South Pacific Deep-Sea sponges (Demospongiae and Hexactinellida). Front. Microbiol. 11:716. doi: 10.3389/fmicb.2020.00716
- Song, H., Hewitt, O. H., and Degnan, S. M. (2020). Arginine biosynthesis by a bacterial symbiont enables nitric oxide production and facilitates larval settlement in the marine-sponge host. Curr. Biol. 31, 433–437.e3. doi: 10.1016/j.cub.2020.10.051
- Xiang, X., Poli, D., Degnan, B. M., and Degnan, S. M. (2022). Ribosomal RNA- depletion provides an efficient method for successful dual RNA-Seq expression profiling of a marine sponge holobiont. Mar. Biotechnol. 24, 722–732. doi: 10.21203/ rs.3.rs-1544807/v1
- Fernandez-Valverde, S. L., Calcino, A. D., and Degnan, B. M. (2015). Deep developmental transcriptome sequencing uncovers numerous new genes and enhances gene annotation in the sponge Amphimedon queenslandica. BMC Genomics 16, 387–311. doi: 10.1186/s12864-015-1588-z
Новость подготовила
© Ю.В.Люпина
04.12.2023