© 2024 by the authors. Licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution (CC BY) license https://creativecommons.org/licenses/by/4.0/

Область научных интересов: межклеточные и клеточно-матриксные взаимодействия, регенеративная медицина, бесклеточная терапия, опухолево- стромальные взаимодействия, опухолевое микроокружение.
За последнее десятилетие произошли кардинальные изменения в подходах лечения рака: активно разрабатываются иммунотерапевтические препараты, которые усиливают иммунный ответ для уничтожения раковых клеток в инфильтрированных тканях, и препараты, воздействующие на микроокружение опухоли (англ. tumor microenvironment, TME), а именно, на опухоль-ассоциированные фибробласты (англ. сancer-associated fibroblasts, CAFs) и внеклеточный матрикс (англ. extracellular matrix, ECM) (см. Новость от 20.12.2022 г.).
Иммунные клетки, инфильтрирующие ТМЕ, играют ключевую роль в инвазии опухолевых клеток и прогрессировании опухоли (рис. 1), а особенности иммунологической экспрессии напрямую коррелируют со скоростью роста. Согласно недавним исследованиям, дисфункция Т-клеток или «истощение» Т-клеток, развивающееся в ответ на постоянное воздействие антигена, является критическим барьером для успешного противоопухолевого иммунитета. Дисфункциональные или «истощенные» Т-клетки, присутствующие в злокачественных опухолях, характеризуются устойчивой и разнообразной экспрессией ингибирующих рецепторов, называемых иммунными контрольными точками (англ. immune checkpoint), например, таких как PD-1, PD-L1, CTLA-4 (расшифровку см. в подписи к рисунку 1). Эти рецепторы отвечают за подавление пролиферации центральных эффекторов противоопухолевого иммунитета – цитотоксических Т-лимфоцитов (англ. cytotoxic T lymphocytes, CTLs) – и выработку ими провоспалительных цитокинов (Thommen et al., 2015; Wolf et al., 2020). Кроме того, было показано, что в солидных опухолях инфильтрированные NK (от Natural killer) клетки, или естественные киллеры, реагируют на условия внутри опухоли и переходят в сохраняемое опухолью состояние покоя, отличное от состояния циркулирующих NK-клеток в нормальных тканях (Dean et al., 2024). Адаптация к ТМЕ сопровождается нарушением основных эффекторных функций NK, а именно, эффективного уничтожения раковых клеток, рекрутирования и активации дендритных клеток (англ. dendritic cells, DCs). DCs, по крайней мере, некоторые из них, вместо миграции в лимфатические узлы задерживаются внутри опухоли, где они «истощаются», с нарушеннием способности стимулировать противоопухолевые иммунные реакции и усилением сигналов, которые могут даже подавлять противоопухолевую функцию других иммунных клеток (Lee et al., 2024).
Метаанализы опубликованных экспериментальных данных с иммуногистохимической характеристикой опухоль-ассоциированных макрофагов (англ. tumor-associated macrophages, TAMs), макрофаги типа 2 (М2), одна из субпопуляций супрессорных клеток миелоидного происхождения (англ. myeloid-derived suppressor cells, MDSCs)), показали, что ответ на лечение и общая выживаемость онкологических больных зависят от плотности и полярности макрофагов, а также сопутствующего присутствия гранулоцитарных MDSCs (нейтрофилов), опухоль-инфильтрирующих лимфоцитов (англ. tumor-infiltrating lymphocytes, TILs), таких как CTLs, эффекторных Т-клеток и NK-клеток, и других иммунных клеток в TME, уровни которых специфичны для разных типов рака (Zhang et al., 2012; Bill et al., 2023; Laberiano-Fernandez et al., 2023; Banuelos et al., 2024; Di Ceglie et al., 2024; Majid et al., 2024). Так, например, для «горячих» опухолей характерно увеличение активности макрофагов типа 1 (M1) и TILs (CTLs, эффекторных Т-клеток и NK-клеток) и повышение экспрессии иммунных контрольных точек. В то время как, «холодные» опухоли, к которым относят солидные опухоли (протоковую аденокарциному поджелудочной железы, колоректальный рак и меланому), являются слабоиммуногенными. В холодных опухолях увеличивается активность противовоспалительных клеток (TAMs, регуляторных Т-клеток (англ. regulatory T cells, Treg)) и подавляется активность провоспалительных клеток (CTLs). Последние обнаруживаются по краям опухоли, эти клетки характеризуются низкой экспрессией маркеров активации, гранзима В и гамма-интерферона. Считается, что TAMs, расположенные также на периферии опухоли, препятствуют проникновению CTLs в ядро опухоли.
Метаанализ опубликованных иммуногистохимических данных об инфильтрации NK-клеток в солидные опухоли показал, что инфильтрация NK-клеток независимо предсказывает риск смерти и общую выживаемость. Прогностическая ценность NK-клеток связана со стадией и степенью опухоли, а также с ее субопухолевым расположением. Было показано, что интраэпителиальная инфильтрация является лучшим предиктором общей выживаемости, чем инфильтрация NK в строме, прилегающей к опухоли (Nersesian et al., 2021).
По сути, прогноз общей выживаемости и реакция пациента на лечение напрямую зависят от иммунного ландшафта рака.
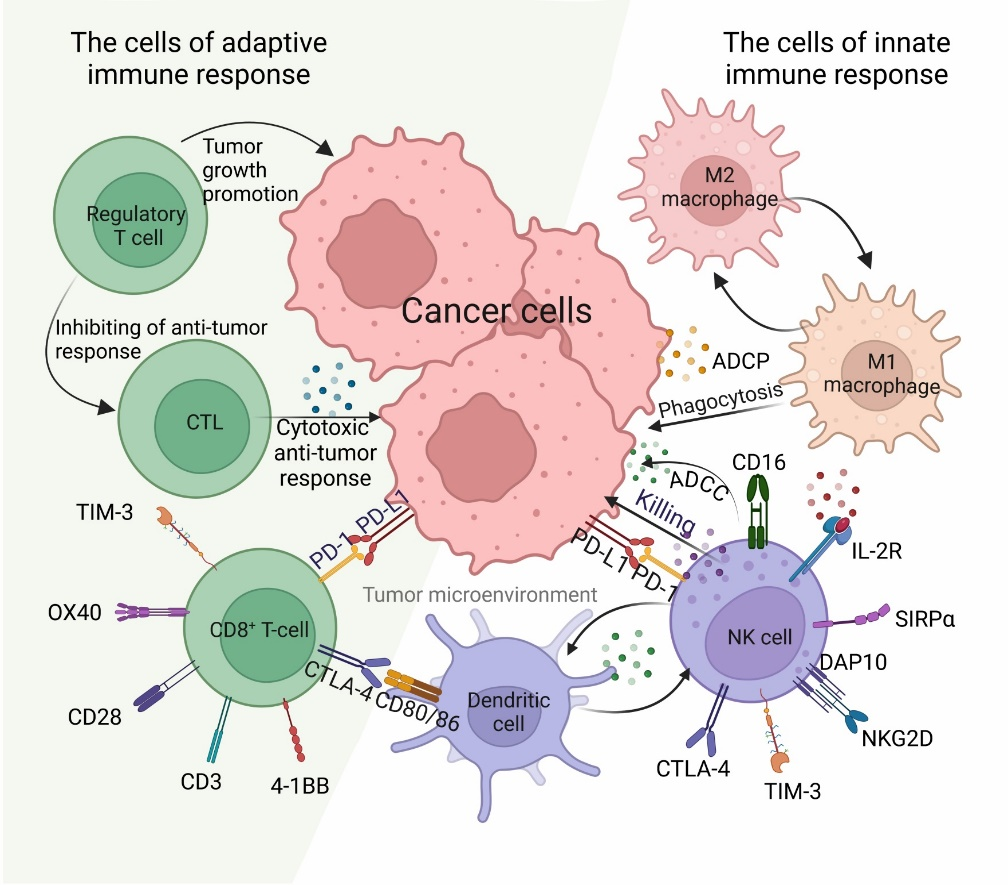
Рис. 1. Схематическая иллюстрация иммунного надзора за микроокружением опухоли. ADCC, антителозависимая клеточно-опосредованная цитотоксичность (англ. antibody-dependent cell-mediated cytotoxicity); ADCP, антителозависимый клеточный фагоцитоз (англ. antibody-dependent cellular phagocytosis; CTLA-4, cytotoxic T lymphocyte-associated protein 4; PD-1, programmed cell death protein 1; PD-L1, programmed cell death ligand 1. (This image was created with BioRender (https://biorender.com/)).
В представленной статье предложен обновленный, критический и исчерпывающий обзор современных подходов к иммунотерапии солидных опухолей, среди которых различные типы целевых моноклональных антител (англ. monoclonal antibodies, mAbs), включая ингибиторы иммунных контрольных точек (англ., immune checkpoint inhibitors, ICIs), би- или триспецифические усилители иммунных клеток (англ. immune cell enhancers, ICEs) и дериваты моноклональных антител (конъюгат антитело-лекарственное средство (англ. antibody–drug conjugates, ADC)), а также адаптивный перенос клеток (англ. adoptive cell transfer, ACT)/клеточная терапия. Обзор сопровождается 7 иллюстрациями, визуально помогающими понять информацию неспециалистами. Согласно названию, обзор сосредоточен на проблемах и перспективных стратегиях иммунотерапии солидных опухолей, хотя иммунологические методы лечения несолидных опухолей также обсуждаются в сравнении. Некоторые из представленных в обзоре видов иммунотерапии нацелены непосредственно на опухолевые клетки, в то время как некоторые другие направлены на нейтрализацию иммуносупрессивных элементов в TME и преобразовании его из иммунологически «холодного» в «горячий». Последнее достигается путем усиления эффекторной функции эндогенных иммунных клеток, улучшения инфильтрации CTLs, NK-клеток и макрофагов M1, а также устранения или ингибирования инфильтрации Treg и MDSCs (в т.ч. TAMs). Хотя многие из этих подходов получили клиническое одобрение, каждый из них имеет свои ограничения. Различные подходы к таргетной иммунотерапии солидных опухолей, обсуждаемые в статье, суммированы на рисунке 2. Для примера, под цифрой 1 на рисунке 2A,B,C, показано, что использование определенных хемокинов способствует рекрутированию соответствующих иммунных клеток в TME, а использование определенных цитокинов – их специфической активации.
Использование mAbs (цифра 3 на рис. 2A,B,C) изменило парадигму терапии рака. По сравнению с химиотерапией точное воздействие на поверхностные антигены опухоли значительно снижает нецелевую токсичность. За последние десятилетия значительное количество mAbs было одобрено для лечения различных солидных опухолей. Однако лечение только mAbs часто оказывается недостаточным из-за постоянных проблем, таких как иммуногенность, резистентность и отсутствие ответа у значительной части пациентов. Таким образом, возникла новая концепция, известная как ADC, которая была задумана, чтобы преодолеть разрыв между mAbs и цитотоксичностью низкомолекулярных препаратов. ADC состоит из mAb, нацеленного на опухоль, и цитотоксической полезной нагрузки, связанной посредством химического линкера. Если нагрузка ADC достаточно проницаема для цитоплазматических мембран, она может диффундировать из клетки, в которой она была высвобождена, и убивать окружающие раковые клетки. Этот механизм, так называемый эффект «убийства свидетеля», не только усиливает цитотоксичность ADC, но и позволяет ему воздействовать на опухоли с гетерогенной экспрессией целевого антигена, тем самым продлевая терапевтический эффект.
В истории иммунных контрольных точек было сделано два важных открытия. Выяснилось, что блокада CTLA-4/CD80/CD86, «тормоза» иммунной системы, и блокада оси PD-1/PD-L1, подавляющая пролиферацию, выживаемость и эффекторные функции Т-лимфоцитов, потенциально может реактивировать «истощенные» Т-клетки при инфекционных заболеваниях и раке. Это привело к активному развитию ICIs (цифра 2 на рис. 2A,B,C), которые «подпитывают» иммунный ответ путем активации внутриопухолевых цитотоксических лимфоцитов и усиления Т-клеточной инфильтрации в TME. ICIs, хотя не стимулируют непосредственно иммунные клетки к избирательной идентификации и уничтожению раковых клеток, играют решающую роль в усилении иммунного ответа против рака. Однако, хотя ICIs и могут пробудить иммунную систему и восстановить «истощенные» Т-клетки, это новообретенное противоопухолевое состояние часто является временным. Еще одна проблема, связанная с использованием ICIs, заключается в том, что не все пациенты реагируют на такое лечение; некоторые пациенты могут первоначально ответить, но со временем развивается резистентность, что в конечном итоге приводит к прогрессированию заболевания; частота ответов может значительно варьироваться в зависимости от типа рака.
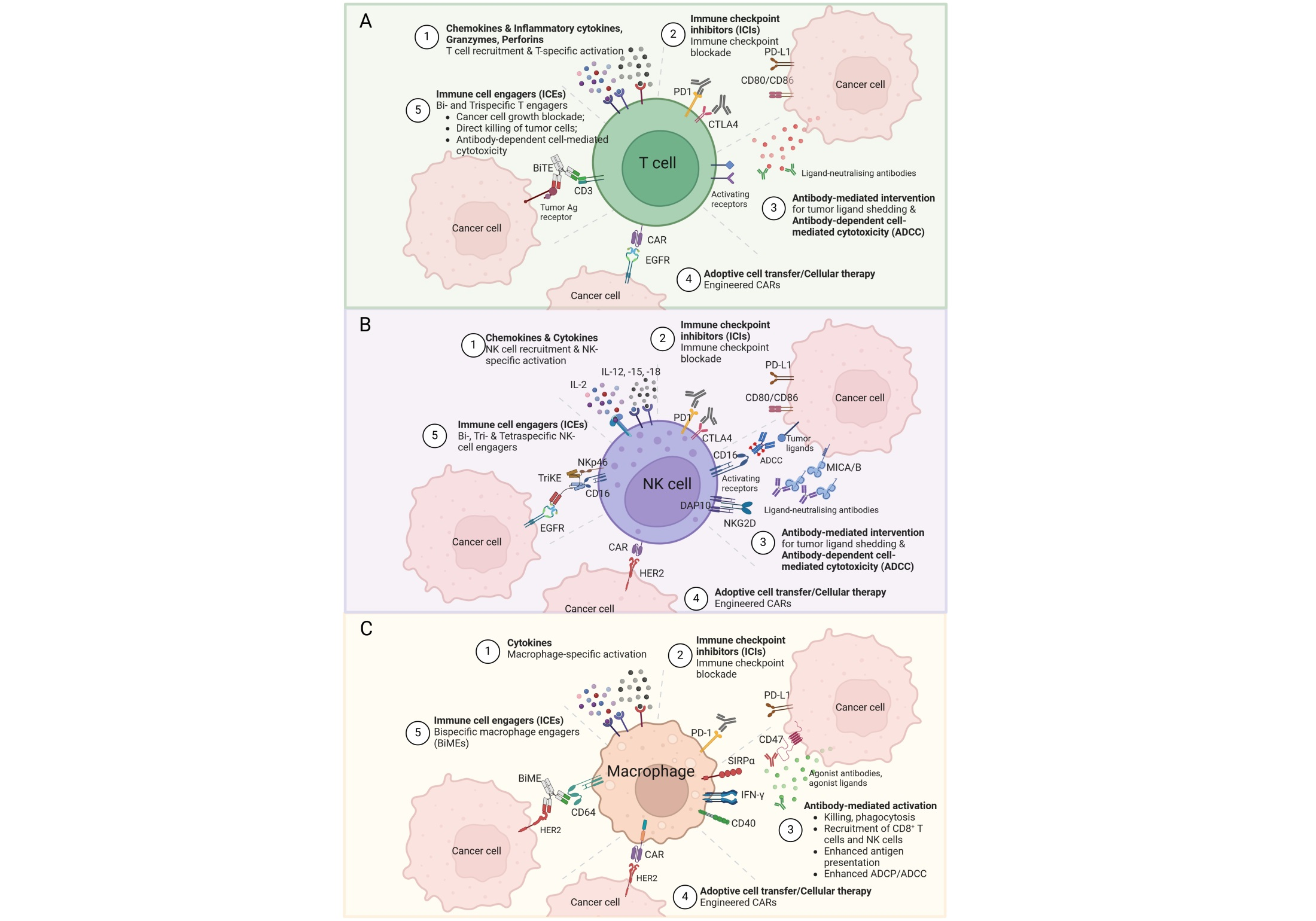
Рис. 2. Различные стратегии иммунотерапии солидных опухолей: (A) Подходы на основе Т-клеток; (B) Подходы на основе NK-клеток; (C) Подходы на основе макрофагов. (This image was created with BioRender (https://biorender.com/)).
ICEs были специально разработаны для перенаправления иммунных клеток на поверхностные опухолеассоциированные антигены (англ. tumor-associated antigens, TAA) для HLA-независимой элиминации раковых клеток и генерации иммунных ответов против слабоиммуногенных опухолей (цифра 5 на рис. 2A,B,C). Большинство ICEs представляют собой транссвязывающие биспецифические антитела (англ. bispecific antibodies), состоящие из двух связанных одноцепочечных антител, одно плечо (scFv) которых связывает ТАА, а другое направлено на цитотоксическую триггерную молекулу, точнее, на активирующий рецептор эффекторной клетки, включая CD3 или костимулирующие молекулы, такие как CD28 или 4-1BB для рекрутирования Т-клеток, CD16a (также известный как FcγRIII) или NKG2D для NK-клеток и CD64 (также известный как FcγRI) для цитотоксических/фагоцитарных клеток. В настоящее время в клинических испытаниях проходят более 100 мультиспецифических антител (би-, три- и даже тетраспецифические антитела). Преимуществом BiKEs (bispecific NK-cell engagers) и TriKEs (trispecific NK-cell engagers) считается повышенное биораспределение из-за их низкой молекулярной массы и низкой иммуногенности. Однако до сих пор остается под вопросом, приведет ли повышенное биораспределение к дополнительной инфильтрации NK-клеток в ТМЕ или оно повлияет только на уже инфильтрированные NK-клетки. Поскольку BiKEs и TriKEs являются полностью искусственными рекомбинантными белками массой 50–75 кДа, чужеродными для человека, их низкая иммуногенность по сравнению с терапевтическими антителами остается открытым вопросом. Продолжающиеся испытания дадут надежные ответы на эти вопросы.
Раздел «клеточная терапия/адаптивный перенос клеток (АСТ)» посвящен терапии T-, NK-клетками и макрофагами. Помимо клинически наиболее продвинутой технологии на основе CAR-T-клеток (см. Новость от 01.04.2024 г.) (цифра 4 на рис. 2A,B,C), в обзоре рассматриваются и другие виды клеточной терапия, включая терапию на основе TILs и T-cell receptor (TCR) клеточную терапию. Кроме того, в статье приводится интересное резюме (таблица) по сравнению преимуществ/недостатков использования иммунных клеток CAR-T, CAR-NK и CAR-M.
В заключении обзора представлено простое «правило 3C», которое будет полезно для иммунотерапевтических подходов:
1. Consolidate … Объединить гистологическое подтипирование с молекулярно-генетическим анализом, чтобы предсказать реакцию пациента на лечение. Это позволяет нацелить терапию на конкретные механизмы канцерогенеза и, соответственно, назначать эффективные методы лечения, подходящие конкретным пациентам.
2. Crack … Взломать защитные системы как раковых клеток, так и ТМE путем одновременного лечения, воздействуя на сами раковые клетки, а также на CAFs и белки ECM в ТМE. Это будет способствовать лучшему преодолению защитных механизмов как раковых клеток, так и ТМE. Рекомендуется использовать клеточную иммунотерапию одновременно с лечением малыми молекулами для уничтожения раковых клеток до того, как они разовьют устойчивость к цитотоксическому действию малых молекул.
3. Cogitate … Поразмышлять над интерактивным использованием нескольких типов CAR-иммунных клеток (CAR-T, CAR-NK, CAR-M, CAR-NKT и т.д.) параллельно или последовательно. Ожидается, что это компенсирует ограничения каждого из них и вызовет иммунный ответ, максимально приближенный к естественному.
Новость подготовила
© В.Е.Дьяконова
04.07.2024
