
 © Елена Воронежская, доктор биологических наук, руководитель лаборатории сравнительной физиологии развития. Область научных интересов: участие нейротрансмиттерных веществ в механизмах нейрогенеза.
© Елена Воронежская, доктор биологических наук, руководитель лаборатории сравнительной физиологии развития. Область научных интересов: участие нейротрансмиттерных веществ в механизмах нейрогенеза.
© Виктория Мельникова, кандидат биологических наук, старший научный сотрудник лаборатории сравнительной физиологии развития. Область научных интересов: нейроэндокрино-иммунные взаимодействия в онтогенезе, нейробиология развития, участие нейротрансмиттеров в регуляции развития периферических органов.
Поведение позвоночных животных, включая человека, определяется не только активностью мозга. Для быстрого принятия решений в критических ситуациях большое значение имеет также работа эндокринной системы. Одной из таких эндокринных желез являются надпочечники. В ответ на стрессовые факторы, такие как опасность, физическая нагрузка, клетки мозгового вещества надпочечников (хромаффинные клетки) выбрасывают в кровь адреналин и норадреналин. Так что именно от активности хромаффинных клеток зависит возможность организма адаптироваться к стрессовым ситуациям, быстро ориентироваться в ситуации, определяя стратегию ответа «бей или беги». Результаты single-cell-транскриптомного анализа клеток эмбриональных надпочечников показали, что в популяции короткоживущих клеток-предшественников (так называемых bridge-cells) экспрессируется рецептор к серотонину Htr3 a (Рис. 1). Однако значение и последствия активации этих рецепторов в процессе развития плода оставались загадкой. В серии экспериментов, проведенных сотрудниками ИБР РАН совместно с коллективами нескольких международных научных институтов, было доказано, что по мере дифференцировки хромаффинных клеток возрастает уровень выделяемого ими серотонина, который как бы подает сигнал "достаточно" промежуточной популяции bridge-cells (Рис. 2). Действуя через свой рецептор Htr3a, серотонин вызывает удлинение клеточного цикла bridge-cells предшественников, что уменьшает их количество, и останавливает генерацию хромаффинных клеток. Меньшее количество bridge-cells, доступных для дифференцировки, дает в результате меньшее количество хромаффинных клеток и финальное уменьшение мозгового вещества надпочечников. Таким образом, чувствительные к серотонину bridge-cells являются частью петли отрицательной обратной связи, управляющей размером популяции хромаффинных клеток надпочечников. Интересно, что обнаруженный механизм контроля количества хромаффинных клеток является однонаправленным. Отсутствие синтеза серотонина у трансгенных животных или фармакологическая блокада рецептора Htr3a не приводят к чрезмерному росту числа хромаффинных клеток. Это согласуется с предыдущими исследованиями , показывающими, что избыток серотонина оказывает более сильное влияние на развитие, например на дифференцировку клеток мозга, чем его недостаток.
По всей видимости, серотонин-зависимый контроль количества хромаффинных клеток защищает от чрезмерного роста надпочечников и потенциального развития опухолей. Представленные в статье эксперименты на клеточных линиях детской нейробластомы показали более высокий туморогенный потенциал линий с высокой экспрессией рецептора Htr3a in vivo и in vitro. Выявленная в экспериментах in vitro возможность подавления пролиферации опухолевых клеток селективным антагонистом рецепторов Htr3a открывает возможности для разработки новых терапевтических стратегий борьбы с определенными типами опухолей, особенно в комбинации с препаратами, индуцирующими дифференцировку клеток. Помимо противоопухолевых функций, серотонин-зависимый контроль формирования хромаффинных тканей имеет важное значение при формировании стратегий поведения потомков, что в свою очередь, имеет экологические и эволюционные последствия. Одним из основных источником эмбрионального серотонина в период активного формирования надпочечников является плацента, уровень серотонина в которой очень изменчив и чутко реагирует на внешние условия, в которых находится беременная мать. Так, физическая нагрузка, умеренный стресс, вызванный социальными контактами, воспаление и состояние здоровья матери, являются факторами, регулирующими поступление серотонина из плаценты к плоду. В наших экспериментах умеренный пренатальный стресс у беременных самок приводил к повышению уровня серотонина у плодов, что приводило к уменьшению мозгового вещества надпочечников и изменению паттернов поведения потомства. Индивидуальные уровни агрессивного поведения, опосредованные выбросом адреналина и норадреналина надпочечниками, проявляются в реакциях животных на широкий спектр проблем. При этом выделяют две основные стратегии преодоления трудностей — проактивную и реактивную. Проактивный тип характерен для агрессивных самцов, которые демонстрируют жесткие и импульсивные реакции и склонность защищать свою домашнюю территорию. Реактивный тип проявляют неагрессивные самцы, которые более дружелюбные, менее тревожные и более гибко реагирующие на внешние сигналы. Наши результаты показали, что пренатальный стресс или введение предшественника серотонина в течение критического временного окна во время беременности приводит к рождению потомства с предпочтительно реактивным типом стратегии преодоления трудностей. Такие животные более приспособлены к выживанию в меняющихся условиях внешней среды.
Следует отметить, что молекулярные механизмы, контролирующие размер хромаффинных органов, важны как для естественного, так и искусственного отбора. Подтверждением этой идеи служат данные о том, что снижение агрессивности, уменьшение размера надпочечников и изменения в синтезе серотонина являются частью так называемого “синдрома одомашнивания”, наблюдаемого у ряда видов. В соответствии с этими поведенческими паттернами, связанными с одомашниванием, наши экспериментальные грызуны, подвергшиеся серотонин-индуцированной редукции надпочечников, демонстрировали менее агрессивные реакции и сниженный уровень катехоламинов.
Мы предположили, что серотонин-зависимый механизм передачи информации от матери к потомству может быть более очевидным в дикой популяции в условиях критического экологического стресса. В качестве модели мы выбрали колебание численности популяции диких полевок (Clethrionomys rutilus), наблюдаемое в Центрально-Сибирском природном биосферном заповеднике в бассейне р. Енисей. Колебание численности полевок периодически достигает исключительных значений, в результате появляющееся поколение разделяется на резидентов и мигрантов, формируя циклы популяционных волн. Мы обнаружили, что размер медуллы надпочечников значимо меньше именно у мигрантов и предположили, что это обусловлено социальным стрессом у беременных животных на пике численности популяции. Согласно обнаруженному нами механизму, это приводит к рождению достаточного количества потомков с реактивной стратегией преодоления трудностей, которые и обеспечивают миграцию вида, смену его ареала и освоение новых территорий.
Обнаруженный нами механизм раскрывает один из возможных путей эпигенетического контроля формирования поведения у потомства через серотонин-зависимый контроль развития надпочечников. Концептуально, аналогичная серотонин-опосредованная передача информации от матери к потомству была выявлена нами ранее у беспозвоночных животных (Ivashkin et al., 2015). Полученные новые результаты позволяют предположить, что обнаруженный механизм может лежать в основе общей древней стратегии серотонин-опосредованной регуляции в природе. В целом, описанный путь контроля количества хромаффинных клеток с помощью серотонин-чувствительных клеток-предшественников является одним из регуляторных серотонин-опосредованных механизмов пренатального программирования долгосрочных изменений в потомстве, лежащих в основе поведения одомашненных видов, а также диких животных с активными и реактивными типами стратегии преодоления трудностей.
Исследование проведено сотрудниками Института биологии развития имени Н.К. Кольцова РАН (Москва) в коллаборации с коллективами Каролинского института (Швеция), Медицинского университета Вены (Австрия) и международных научных институтов Германии, Чехии, Италии и Франции.
Основные результаты исследования представлены на сайте Российского научного фонда: https://www.rscf.ru/news/biology/izbytok-gormona-schastya/

Рис. 1.
Single-cell-транскриптомный анализ клеток эмбриональных надпочечников. Экспрессия серотонинового рецептора Htr3a обнаружена только на непосредственных предшественниках хромаффинных клеток (bridge-cells).
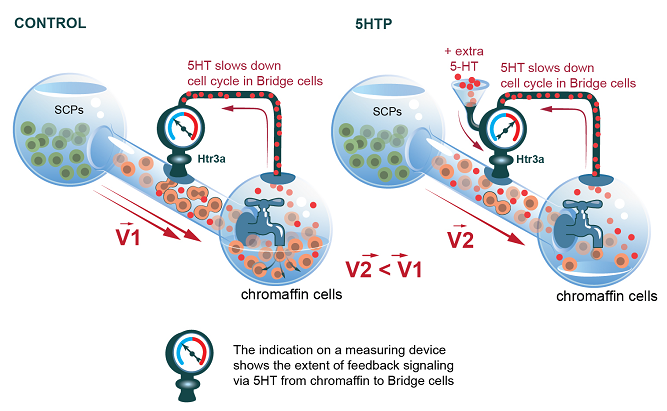
Рис. 2.
Схематическое представление серотонин-опосредованного механизма контроля дифференцировки хромаффинных клеток надпочечников в пренатальном периоде развития.
Новость подготовили
© Елена Воронежская и Виктория Мельникова
04.07.2022