 © Алёшина Нина Максимовна, аспирант ИБР РАН, старший лаборант лаборатории проблем регенерации.
© Алёшина Нина Максимовна, аспирант ИБР РАН, старший лаборант лаборатории проблем регенерации.Область научных интересов: оо- и фолликулогенез, раннее развитие млекопитающих, а также роль трансмиттеров в этих процессах.
В последние годы в сфере вспомогательных репродуктивных технологий набирает популярность практика преимплантационного генетического тестирования (ПГТ). Это исследование позволяет предсказать генетические патологии у плода путем скрининга клеток, полученных при биопсии эмбриона на третий или пятый день развития. Благодаря этой методике становится возможным повысить эффективность процедуры ЭКО, снизив процент замерших беременностей и самопроизвольных абортов, а также выявить анэуплоидные эмбрионы и те, что имеют наследственные заболевания (в том числе сцепленные с полом). В то время как большинство процедур ПГТ нацелено на определение мутаций в конкретном гене, вызывающие редкие и тяжелые заболевания, большинство гораздо более распространенных болезней, таких как порок сердца, диабет второго типа, рак, возникают из-за мутаций в нескольких генах одновременно. Метод полногеномного секвенирования в данном случае также ограничен ввиду высокой стоимости и трудоемкости из-за того, что ДНК, полученная из одной или нескольких клеток эмбриона, имеет критически малый объем и, зачастую, низкое качество. Авторы мартовской публикации в журнале Nature расширили стратегию, названную «полногеномной реконструкцией» (ПГР), в которой объединяются данные, полученные при генотипировании эмбриона и будущих родителей.
В исследовании участвовали 110 эмбрионов от 10 пар. Ученым удалось оценить риски 12-ти синдромов, включая некоторые виды рака, а также сердечные и аутоиммунные заболевания. Впоследствии полученные результаты сравнивали с данными секвенирования геномов уже рожденных малышей, и оказалось, что предсказанное имело точность в 97-99%.
Для того, чтобы осуществить метод ПГР, выполнили полногеномное секвенирование ДНК родителей с высоким значением покрытия. Комбинация молекулярных и статистических подходов позволила ученым связать родительские гены в «гаплотипы» (совокупность аллелей на участках одной хромосомы, которые наследуются вместе), которые соответствовали отдельным хромосомам, определить сайты мейотической рекомбинации и собрать соответствующие сегменты гаплотипа, чтобы воссоздать весь унаследованный геном эмбриона. Эффективность прогнозирования зависела от срока развития зародыша: при биопсии эмбрионов на третий день она составила около 97%, а на четвертый – 99%.
Ученые рассмотрели вариативность риска полигенных заболеваний среди эмбрионов, полученных от разных пар, а также между эмбрионами каждой пары. Наибольшая вариативность возникала в случае аутоимунных заболеваний, таких как сахарный диабет 1-го типа или витилиго, однако риск их развития составлял менее 10% ввиду их редкости как для эмбрионов-сиблингов, так и для зародышей от разных семей. Наибольшие значения риска обнаруживались для более распространенных заболеваний, таких, как болезни сердца.
Часть работы, в которой оценивался критерий прогнозирования риска развития заболевания в рамках выбора эмбриона для переноса в матку, вызывает большой интерес. Так, исследователи изучили результаты ПГТ пары, в которой мать являлась носителем патологического варианта гена BRCA1, одного из факторов, вызывающих рак груди. В семейном анамнезе этой пары также были случаи заболевания раком груди. Из 20 эуплоидных эмбрионов 13 имели патологический вариант гена BRCA1. Исследователи использовали полигенную шкалу рисков, которая прогнозирует шансы развития заболевания на основании данных секвенирования биоптата, и статус носительства патологического варианта BRCA1 в роли отдельных переменных (Рис. 1, а). Внутри группы эмбрионов, полученных от одной пары, прогнозируемый риск развития рака груди у эмбрионов-носителей превышал таковой у их сиблингов, не являющихся носителями, в 15 раз. Однако, в группе эмбрионов, в которой не было носителей патологического варианта BRCA1, оказались зародыши с высокими показателями полигенной шкалы риска. Также обнаружилось, что в группе эмбрионов-носителей этого гена присутствовали имеющие как высокие значения полигенной шкалы риска, так и низкие. Таким образом, оба этих подхода – как использование полигенной шкалы рисков, так и статус носительства, не могут давать точных прогнозов при выборе эмбриона для переноса. Это исследование показывает, что использование ограниченного на данный момент метода оценки рисков развития заболеваний, используемого в сфере вспомогательных репродуктивных технологий, может приводить к ошибочному переносу высокорисковых эмбрионов.
Несмотря на потрясающую точность предсказания предложенного метода полногеномной реконструкции, подтвержденного сравнением с геномами уже родившихся малышей, авторы подчеркивают, что есть еще несколько аспектов, которые стоит улучшить или рассмотреть более подробно. Так, невозможным остается предсказание мутаций, возникающих в гаметах или в клетках эмбриона после зачатия. Такие мутации возникают редко, но именно они обуславливают большую часть ранних нарушений развития ЦНС, включая аутизм и умственную отсталость. Авторы отмечают, что более точные прогнозы можно получить при анализе биоптатов из эмбрионов на пятый день развития, нежели на третий. Это обусловлено тем, что из таких эмбрионов можно получить больше клеточного материала. Авторы также подчеркивают ограниченность эффективности метода полигенной шкалы рисков в неевропейских популяциях, так как традиционно исследование генетики человека производилось именно на жителях Европейских стран. Несмотря на то, что сейчас предпринимаются активные попытки расширения генетических баз данных путем включения в них информации о геномах людей из разных уголков земного шара, этих данных все еще недостаточно. И даже среди европейцев показатели шкалы полигенного риска предсказуемы только в пределах небольшого количества людей, что еще раз подчеркивает важность расширения баз данных геномов человека для большей точности прогнозов в подобных тестах.
Авторы также поднимают вопрос полезности использования тестов, прогнозирующих заболевания, для отбора преимплантационных эмбрионов для дальнейшего переноса. Так, в работе было показано, что риски развития различных заболеваний могут варьировать в группах эмбрионов от одной пары с тем же разбросом, что и среди эмбрионов от разных пар. Эти данные ограничивают экстраполирование результатов тестов исследованной группы зародышей на всех эмбрионов-сиблингов от конкретной пары. Именно поэтому в рамках каждого отдельного случая необходим дополнительный сбор информации семейного анамнеза и консультации генетиков. Также авторы отмечают, что развитие конкретного заболевания может и не произойти, так как на малышей, рожденных в новом поколении, будет воздействовать уже новая, изменившаяся среда.
Влияние хромосомного мозаицизма при биопсии клеток эмбриона также остается предметом дискуссий. В данном исследовании не участвовали эмбрионы, у которых была обнаружена анеуплоидия или мозаичность, так как предложенный авторами метод не подходит для прогнозирования рисков для этих эмбрионов.
Включение информации о полигенных рисках в вопрос принятия решения о переносе эмбрионов остается спорным с точки зрения этики. Авторы подчеркивают, что несмотря на то, что их исследование было полностью бесплатным для участвующих в нем пар, доступ к таким технологиям в большинстве случаев остается неравным для разных семей в том числе и из-за высокой стоимости процедур ЭКО. Также исследователи говорят о важности правильного подхода к информированию пациентов – с каждой парой проводились консультации с медицинским генетиком с последующим опросом, в котором оценивалось их понимание общей картины и возможных последствий их выбора. Среди пациентов, обращающихся к помощи вспомогательных репродуктивных технологий в США, нашлось немало желающих воспользоваться услугами скрининга с оценкой шкалы полигенного риска: 68% опрошенных считают включение данного метода в процедуру ЭКО разумным.
С повышением эффективности методов и точности тестов, данная технология занимает прочную позицию на рынке услуг в сфере ВРТ, становясь более доступной и обыденной. Сейчас мы используем ее ради высшей цели, чтобы у участвующей в процедуре ЭКО семьи был шанс на рождение здоровых детей. Однако возможность того, что когда-либо такие методы позволят производить селекцию эмбрионов по признаку цвета глаз или умственных показателей, настораживает. Правовое регулирование данного вопроса остается крайне важным аспектом этики в области ВРТ.
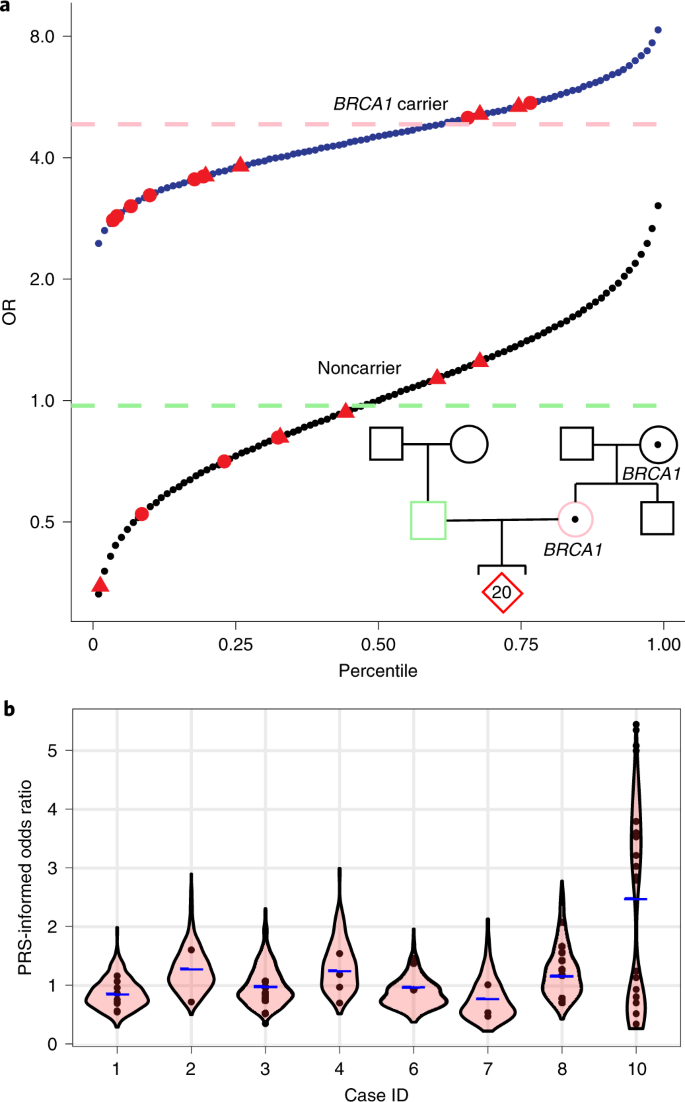
Рис. 1. Внутри- и межсемейные различия в прогнозируемом генетическом риске предрасположенности к раку молочной железы.
a. Объединенный прогноз полигенного/моногенного риска у участников исследования с семейным анамнезом рака молочной железы, с патогенным вариантом гена BRCA1 и большим количеством эмбрионов (красный). Тринадцать эмбрионов являлись носителями патогенного варианта BRCA1. Используя логистическую модель, построенную на данных более чем 22 000 человек из Биобанка Великобритании (UKB), с соответствующей клинической и генетической информацией, используя полигенную шкалу риска (ПШР) и статус носительства в качестве отдельных переменных, предсказана вероятность заболевания для каждого эмбриона. Синяя линия указывает относительный риск как функцию ПШР для носителей BRCA1, а черная линия указывает относительный риск для эмбрионов, не являющихся носителями. Метод учитывает снижение эффективности ПШР в контексте положительного статуса BRCA1, зафиксированное в разнице наклона двух линий. ПШР женщины показан розовой пунктирной линией, а ПШР мужчины – зеленой (как если бы это был женский риск для сравнения).
Эмбрионы мужского пола (треугольники) показаны отдельно.
b. Геномный риск развития рака молочной железы в случае десяти пар и их эмбрионов. Прогнозируемый риск заболевания для каждого эмбриона (кружочки) показан вместе с графиком-скрипкой, отражающим распределение результатов для 500 смоделированных эмбрионов (как описано в разделе публикации «Методы»), при этом средняя родительская ПШР показана синей чертой. Наследование патогенного варианта BRCA1 (А) объясняет повышенную изменчивость и бимодальное распределение риска заболевания раком молочной железы в случае десятой пары.
Новость подготовила
© Алёшина Н.М.
04.04.2022