Область научных интересов: генетика поведения.
Клетки живых организмов постоянно взаимодействуют, обмениваясь друг с другом веществом и информацией. От характера этих взаимодействий зависит развитие, рост, регенерация тканей и такие сложные процессы, как иммунный ответ и работа нервной системы. Зачастую исследованиям, изучающим молекулярные изменения в стареющем мозге на уровне отдельных клеток, не хватает пространственного контекста, особенно в масштабе длины всей жизни организма. Современные методы высокопроизводительной пространственной транскриптомики и искусственного интеллекта (ИИ) открывают перед учеными новые возможности для изучения взаимодействий клеток с высоким пространственным и временным разрешением. Пространственная транскриптомика отдельных клеток позволяет одновременно анализировать активность сотен и тысяч генов в отдельных клетках, сохраняя их положение в ткани. Это помогает понять, как клетки взаимодействуют в сложных биологических системах: от развития отдельных органов эмбриона до формирования опухолей. ИИ же ускоряет обработку огромных массивов данных, выявляя скрытые закономерности в клеточных сетях. Машинное обучение помогает моделировать динамику взаимодействий клеток во времени, что особенно важно для изучения процессов регенерации и дегенерации, иммунного ответа и прогрессирования болезней.
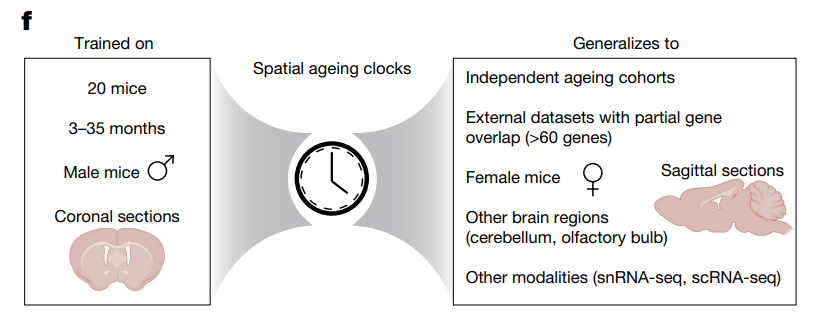
В свежем исследовании, опубликованном в журнале Nature, исследователи из Стэнфордского Университета разработали пространственные часы старения с использованием транскриптомики отдельных клеток для изучения взаимодействий, специфичных для разных типов клеток, и их влияния на старение, омоложение и заболевания мозга. Для картирования участков мозга исследователи создали пространственный транскриптомный атлас отдельных клеток мозга мыши, в котором собрали данные об экспрессии генов из 4,2 миллионов клеток на 20 этапах жизни (от 3 до 34 месяцев), что эквивалентно возрасту человека от 20 до 95 лет, а также после двух омолаживающих вмешательств: физических упражнений и частичного репрограммирования (OSKM: Oct4, Sox2, Klf4, Myc). Изучая эти данные в динамике, исследователи разработали «пространственные часы старения» для прогнозирования биологического возраста отдельных клеток на основе экспрессии генов. Этот метод точно предсказывал возраст клеток в разных областях мозга и типах клеток, включая редкие, такие как нейральные стволовые клетки и Т-клетки. Часы эффективно обобщались по полам, наборам данных и даже другим технологиям секвенированиия отдельных клеток, что подчеркивает их надежность.
Рисунок 1. Схематическое изображение пространственных часов старения.
Было показано, что клеточные взаимодействия — а не только внутренние свойства отдельных клеток — формируют процесс старения. Более того, клеточные взаимодействия качественно изменяются на протяжении всей жизни.
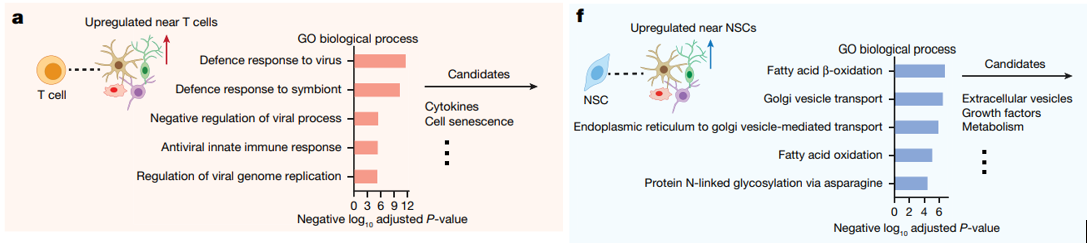
- Во-первых, в различные регионы стареющего мозга проникает всё больше и больше Т-клеток, которые в здоровом мозге обнаруживаются в единичных экземплярах, преимущественно в оболочках мозга и периваскулярных пространствах. Т-клетки оказывают долгосрочное влияние, способствующее старению, на близлежащие клетки мозга, в частности олигодендроциты и перициты, посредством механизмов, связанных с иммунной сигнализацией и воспалением.
- Во-вторых, немногочисленные нейральные стволовые клетки (НСК), локализующиеся в своих нейрогенных нишах, демонстрируют мощное омолаживающее воздействие на близлежащие клетки. Таким образом, помимо их хорошо известной способности генерировать новые здоровые нейроны, НСК также создают благоприятную среду для уже существующих клеток мозга.
Рисунок 2. Молекулярные пути (наиболее обогащенные биологические процессы Gene Ontology (GO)) для значительно активированных генов в клетках вблизи клеток интереса (Т-клеток (a) и НСК (f)) по сравнению с клетками, которые находятся далеко от клеток интереса.
- В-третьих, среди других значительных изменений в пропорциях клеток с возрастом можно отметить увеличение числа микроглиальных клеток, в то время как число НСК и клеток-предшественников олигодендроцитов уменьшилось. Эти изменения были одинаковыми как в коронарных, так и в сагиттальных срезах мозга.
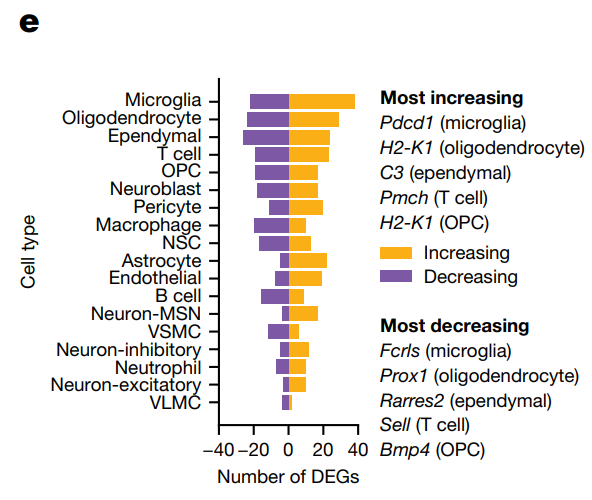
- В-четвертых, исследование также выявило определенные закономерности изменений экспрессии генов в разных областях мозга, причем наибольшие изменения наблюдались в трактах белого вещества. Результаты подчеркивают, что экспрессия генов, связанных с иммунным ответом, увеличивается с возрастом в микроглии, в отличие от экспрессии метаболических генов и генов развития, которая показала возрастное снижение.
Рисунок 3. Количество генов с увеличивающейся или уменьшающейся экспрессией с возрастом для каждого типа клеток в коронарных срезах. Гены с наибольшими изменениями показаны для пяти основных типов клеток.
- В-пятых, эффекты омолаживающих вмешательств также изучались с использованием пространственных часов старения. Физические упражнения и частичное репрограммирование были протестированы на предмет их влияния на старение мозга. Упражнения оказали более широкое воздействие, особенно на сосудистую систему мозга, омолодив несколько типов клеток в разных регионах мозга, в то время как частичное репрограммирование в первую очередь принесло пользу НСК и нейробластам с ограниченными эффектами, специфичными для региона.
Помимо научных фактов статья также представляет ценный ресурс в виде атласа, который заложил основу для разработанного вычислительного инструмента — пространственных часов старения. Часы — это модели машинного обучения, предназначенные для прогнозирования биологического возраста отдельных клеток на основе их генной экспрессии. Этот инструмент, созданный с использованием графовых нейронных сетей, предоставил мощный способ моделирования межклеточных взаимодействий. Создав своего рода мозг in silico, исследователи смогли смоделировать то, что происходит, когда добавляются, удаляются или изменяются определенные типы клеток. Это позволило им исследовать потенциальные вмешательства, которые было бы почти невозможно протестировать в живом мозге. Все созданные инструменты и код лежат в открытом доступе.
Рассматриваемая статья является ярким примером того, что смещение фокуса с изучения отдельных клеток на их взаимодействие в тканевом контексте открывает новые перспективы в понимании старения. Разные клетки по-разному реагируют на те или иные сигналы, а значит будущие методы лечения должны быть адаптированы не только к тканям, но и к конкретным типам клеток в этих тканях. При этом именно редкие типы клеток в мозге могут стать ключом к открытию новых стратегий для повышения устойчивости и долголетия мозга. Открытия данной работы вдохновляют будущие исследования ставить перед собой вопросы о причинно-следственной связи наблюдаемых явлений. Например, интересно, что будет если не позволять Т-клеткам высвобождать свои факторы старения в мозге или если усилить эффекты нейральных стволовых клеток? Вторым важным вопросом является воспроизводимость фактов, полученных на мышах, для тканей человека. Таким образом, инициализируя подобные вопросы, данное исследование является важным кирпичиком в фундаменте, на котором будет строиться персонализированная медицина и разработка новых методов лечения для борьбы с нейродегенерацией и для сохранения когнитивных функций.
Список литературы
- Mattson, M. P. & Arumugam, T. V. Hallmarks of brain aging: adaptive and pathological modification by metabolic states. Cell Metab. 27, 1176–1199 (2018).
- Dulken, B. W. et al. Single-cell analysis reveals T cell infiltration in old neurogenic niches. Nature 571, 205–210 (2019).
- Buckley, M. T. et al. Cell-type-specific aging clocks to quantify aging and rejuvenation in neurogenic regions of the brain. Nat. Aging 3, 121–137 (2023).
- Ximerakis, M. et al. Single-cell transcriptomic profiling of the aging mouse brain. Nat. Neurosci. 22, 1696–1708 (2019).
- Mrdjen, D. et al. High-dimensional single-cell mapping of central nervous system immune cells reveals distinct myeloid subsets in health, aging, and disease. Immunity 48, 380–395.e6 (2018).
- Hammond, T. R. et al. Single-cell RNA sequencing of microglia throughout the mouse lifespan and in the injured brain reveals complex cell-state changes. Immunity 50, 253–271.e6 (2019).
- Ishikawa, T., Mizunoya, W., Shibakusa, T., Inoue, K. & Fushiki, T. Transforming growth factor-β in the brain regulates fat metabolism during endurance exercise. Am. J. Physiol. 291, E1151–E1159 (2006).
Новость подготовила
Гайнуллина Анастасия Наильевна, к.т.н., научный сотрудник лаб. Биоинформатики и молекулярной генетики ИБР РАН;
04.03.2025