Lim HYG, Alvarez YD, Gasnier M, et al. Keratins are asymmetrically inherited fate determinants in the mammalian embryo. Nature. 2020;10.1038, s41586-020-2647-4;
Cockburn, K., & Rossant, J. (2010). Making the blastocyst: lessons from the mouse. Journal of Clinical Investigation, 120(4), 995–1003
 © Муромцев Антон Викторович, магистр I курса Биологического факультета МГУ, студент лаборатории клеточной биологии ИБР РАН
© Муромцев Антон Викторович, магистр I курса Биологического факультета МГУ, студент лаборатории клеточной биологии ИБР РАН
Одним из ключевых событий предимплатационного развития млекопитающих является выделение в эмбрионе двух клеточных линий – внутренней клеточной массы (ВКМ), которая формирует зародыш и примитивную энтодерму, и трофэктодермы, которая формирует плаценту. Механизмы детерминации этих линий до конца не ясны. Существует ряд моделей, описывающих эти события.
Согласно первой модели, клеточные линии дифференцируются под воздействием локальных сигналов после того, как клетки занимают позиции внутри или снаружи эмбриона, то есть судьба клеток зависит от их положения. Среди сигналов, проявляющихся уже на стадии 4-клеточного эмбриона, выделяют модификации гистонов, динамику транскрипционных факторов и локализацию некодирующих РНК.
Вторая популярная модель «клеточной полярности» заостряет внимание на том, что дифференцировка на две клеточные линии происходит в результате асимметричного наследования «детерминант полярности». Так, предполагается, что одной из этих детерминант является апикальный домен, который формируется ещё на 8-клеточной стадии (до формирования ВКМ и трофэктодермы) посредством концентрации F-актина, PAR6 и aPKC в апикальном кортикальном слое клеток. Это, в частности, согласуется с тем, что апикальная полярность на более поздних стадиях обеспечивает ядерную локализацию транскрипционного фактора YAP, который обеспечивает экспрессию CDX2 – ключевого транскрипционного фактора трофэктодермы, определяющего ее идентичность. С другой стороны, прижизненная съёмка эмбрионов показала, что апикальный домен может разбираться ещё до начала деления клетки, то есть напрямую не наследуется. Таким образом, до сих пор неясно, существуют ли какие-либо поляризованные компоненты клетки, которые могут выступать в роли ассиметрично наследуемых детерминант ВКМ и трофобласта.
Механизм детерминации
Молекулярный путь, лежащий в основе детерминации ВКМ и трофэктодермы, предположительно связан с сигнальным путём Hippo. В тех клетках, где путь Hippo заблокирован, не работает киназа Lats1/2, которая фосфорилирует транскрипционный фактор Yap. В результате Yap воздействует на белок Tead4, активируя экспрессию генов и дифференцировку в трофэктодерму. Если же путь Hippo реализуется, то киназа Lats1/2 фосфорилирует Yap, и он не связывается с Tead4, в результате чего происходит дифференциовка клеток во внутреннюю клеточную массу (ВКМ).
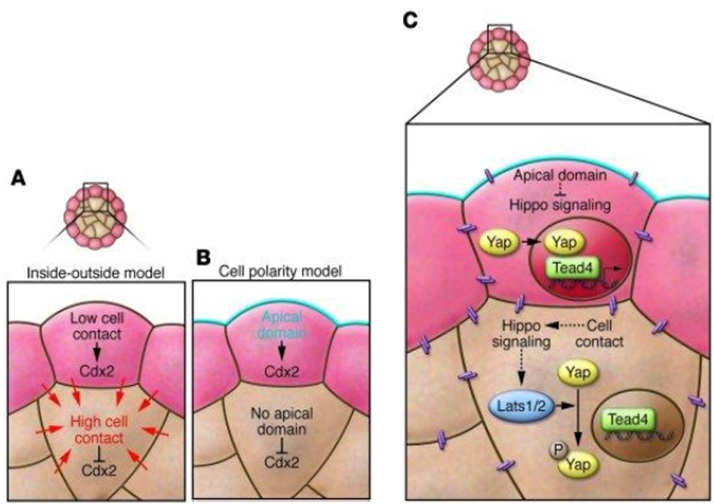
Рисунок 1. А – модель «внутри-снаружи», B – модель клеточной полярности, С – предполагаемый механизм детерминации ВКМ и клеток трофобласта
Кератиновые филаменты наследуются асимметрично ещё до стадии бластоцисты
В новом исследовании группа учёных из Сингапура сосредоточилась на кератиновых филаментах (конкретно на кератине 8 (K8) и кератине 18 (K18), так как это единственная группа цитоплазматических промежуточных филаментов, которая синтезируется в доимплатационный период. Известно, что кератиновые филаменты являются маркерами трофэктодермы. Также они регулируют полярность, активность сигнальных путей и механическую напряжённость в эпителиальных тканях. Нокаутирование кератинов приводит к плацентарным кровотечениям и осложнениям постимплатационного развития.
Исследователи обнаружили, что несмотря на то, что кератины являются маркерами трофэктодермы, их можно детектировать уже на стадии 8-клеточного эмбриона мыши, то есть ещё до детерминации клеток. То же самое справедливо и для эмбриона человека (Рис. 2). По мере развития до стадии бластоцисты кератиновые филаменты концентрируются на поверхности эмбриона так, что в результате внутренние клетки (ВКМ) практически не содержат кератинов. Таким образом, неравномерное содержание кератиновых филаментов характерно для эмбриона на стадиях, предшествующих дифференцировке на ВКМ и трофобласт.
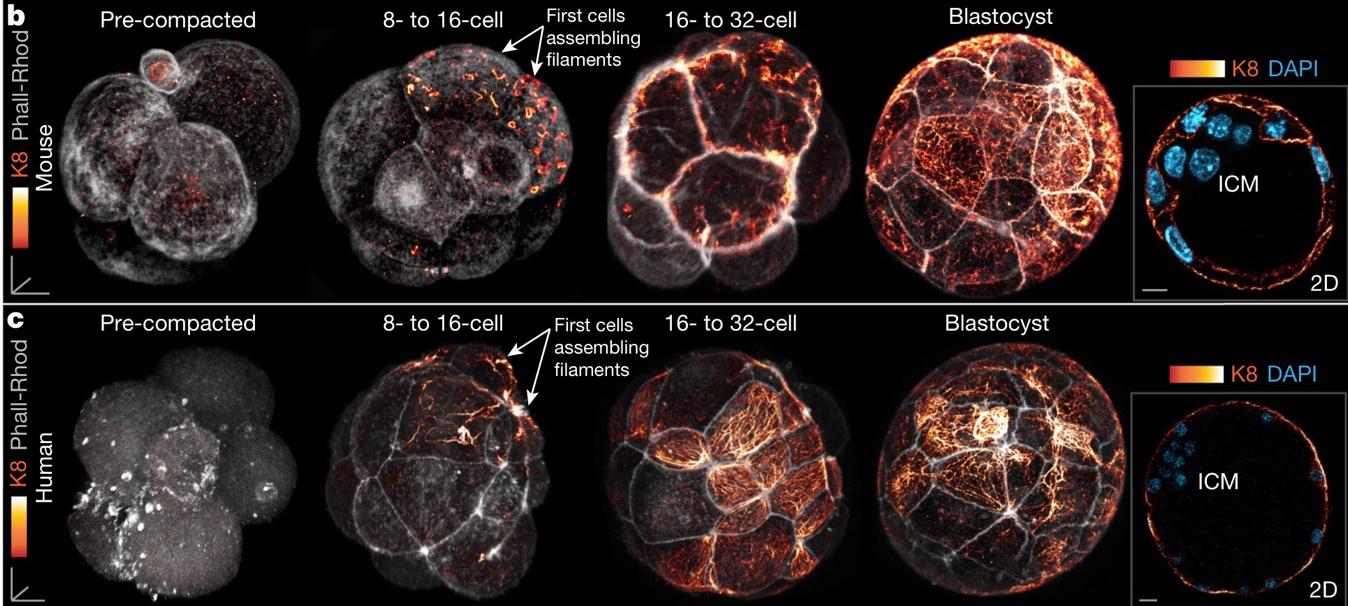
Рисунок 2. Визуализация кератина-8 в эмбрионе мыши (b) и человека (с)
Верхний ряд изображений – эмбрион мыши, нижний – эмбрион человека. Филаменты К18 покрашены в оранжевый цвет разной интенсивности.
Эксперименты по микроинъекции флуоресцентной мРНК K18 (К18ф) показали, что кератины начинают концентрироваться в кортикальной и субкортикальной зонах клеток в течение интерфазы ещё до формирования апикального домена. Однако при формировании апикального домена концентрация кератинов растёт, что указывает на заякоривание филаментов в домене.
Роль десмосом
Несмотря на то, что полноценные десмосомы формируются на стадии бластоцисты, некоторые их компоненты экспрессируются уже на стадии 8-клеточного эмбриона. В частности, в данной работе в апикальном домене иммуногистохимически обнаружены плакоглобин, плакофилин и десмоглеин-2. Ингибирование экспрессии белков десмосом приводило к снижению поляризации кератиновых филаментов. Таким образом, кератиновые филаменты заякорены в апикальном домене при помощи компонентов десмосом
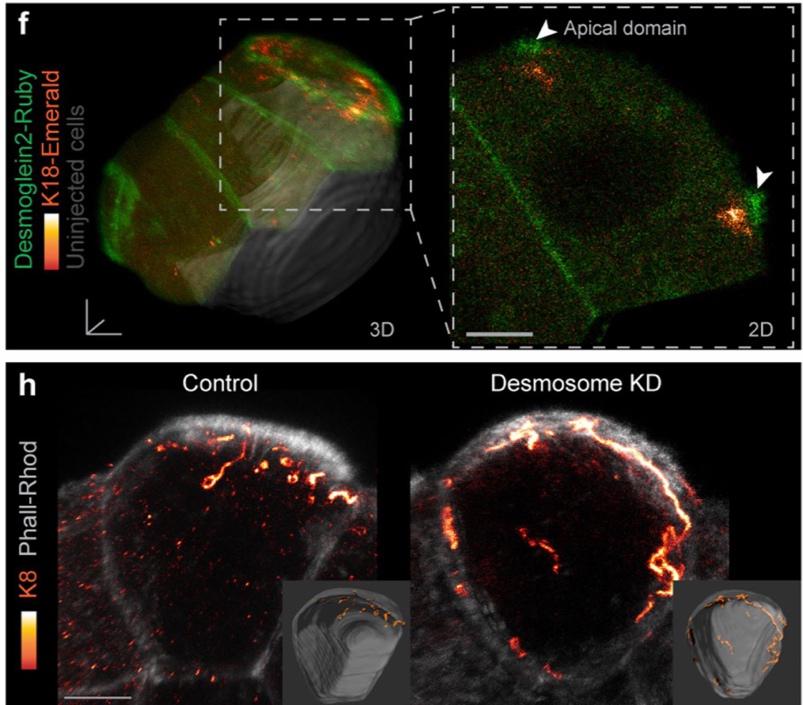
Рисунок 3. f – десмоглеин-2 и кератин-18 концентрируются в области апикального домена, h – ингибирование компонентов десмосом уменьшает поляризованность кератиновых филаментов
Роль актиновых филаментов
Обработка эмбриона цитохалазином D (в период интерфазы) блокирует формирование апикального домена, в результате чего локализация кератины более равномерно распределяются по кортексу и субкортикальной цитоплазме клетки. Напротив, воздействие SiR-актина (стабилизирует F-актин) увеличивает апикальную поляризацию кератинов. Таким образом, актиновый цитоскелет координирует образование апикального домена и концентрирование кератиновых филаментов. Однако при вступлении клетки в митоз апикальный домен исчезает, равно как и компоненты десмосом вместе с микротрубочками. При этом, кератиновые филаменты в митотических клетках расположены стабильно. В частности, с помощью K18ф показано, что кератиновые филаменты неравномерно распределяются между внешней и внутренней дочерними клетками. Митотические клетки имеют плотную сеть актиновых микрофиламентов, которые задерживают движения кератиновых филаментов и обеспечивают сохранение апикальной поляризации в митозе, что и приводит к неравномерному наследованию кератинов.
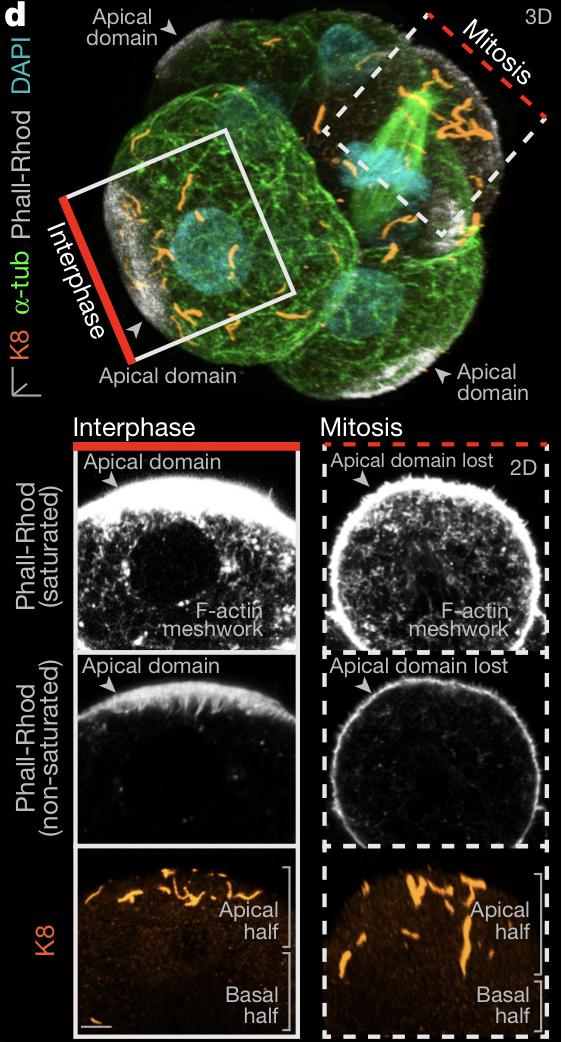
Рисунок 4. d – организация цитосклетеа 8-клетчного эмбриона в интерфазе и во время митоза
Таким образом, наследование кератиновых филаментов в интерфазе обеспечивает апикальный домен, в котором представлены компоненты десмосом для крепления филаментов. Во время митоза апикальный домен редуцируется, и за удержание кератиновых филаментов в прежнем положении ответственна сеть актиновых микрофиламентов, которая за счёт своей высокой плотности не даёт им мигрировать. В результате большинство кератиновых филаментов получает внешняя клетка.
Влияние кератиновых филаментов на спецификацию трофэктодермы
Клетки 8- и 16-клеточных эмбрионов, получившие кератины, образуют их плотную сеть в прикортикальной зоне. Кератин-положительные клетки демонстрируют повышенный уровень ядерных Yap и CDX2 и пониженный уровень Nanog, что является признаком спецификации трофэктодермы.
Кератин-положительные клетки также имеют повышенную экспрессию генов апикальной полярности PARD6B и PKCζ, а также гена mRuby2-actin (введен искусственно), который расположен в апикальном кольце из F-актина. Однако при введении si-РНК к K8 и K18 этот эффект нивелируется. Кроме того, кератин-позитивные клетки, нокаутированные по гену Yap, не экспрессируют CDX2, что подтверждает роль Yap в качестве посредника между кератинами и CDX2. Таким образом, кератины контролируют спецификацию первых клеток трофэктодермы
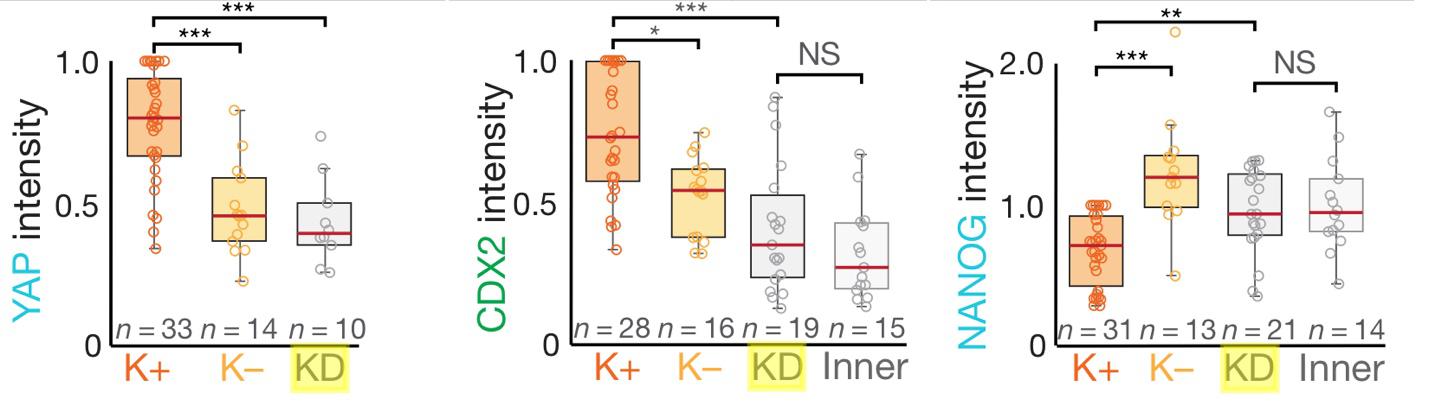
Рисунок 5. Экспрессия ключевых генов кератин-позитивными клетками 9(К+), кератин-негативными клетками (K-), клетками, нокаутированными по кератинам (KD) и внутренними клетками (Inner). Стадия 16-32 клеточного эмбриона
Регуляция экспрессии кератинов
Было обнаружено, что кератин-положительные клетки в основном являются потомками вегетативного бластомера 4-клеточного эмбриона. В то же время этот бластомер имеет самый высокий уровень BAF155 (BRG1-assosiated factor, способствует дифференцировке трофэктодермы, подавляется метилтрансферазой CARM1). Нокаутирование или оверэкспрессия этого гена (введение производилось на стадии 1 и 2 клеток) приводили к подавлению или стимуляции экспрессии кератиновых филаментов соответственно.
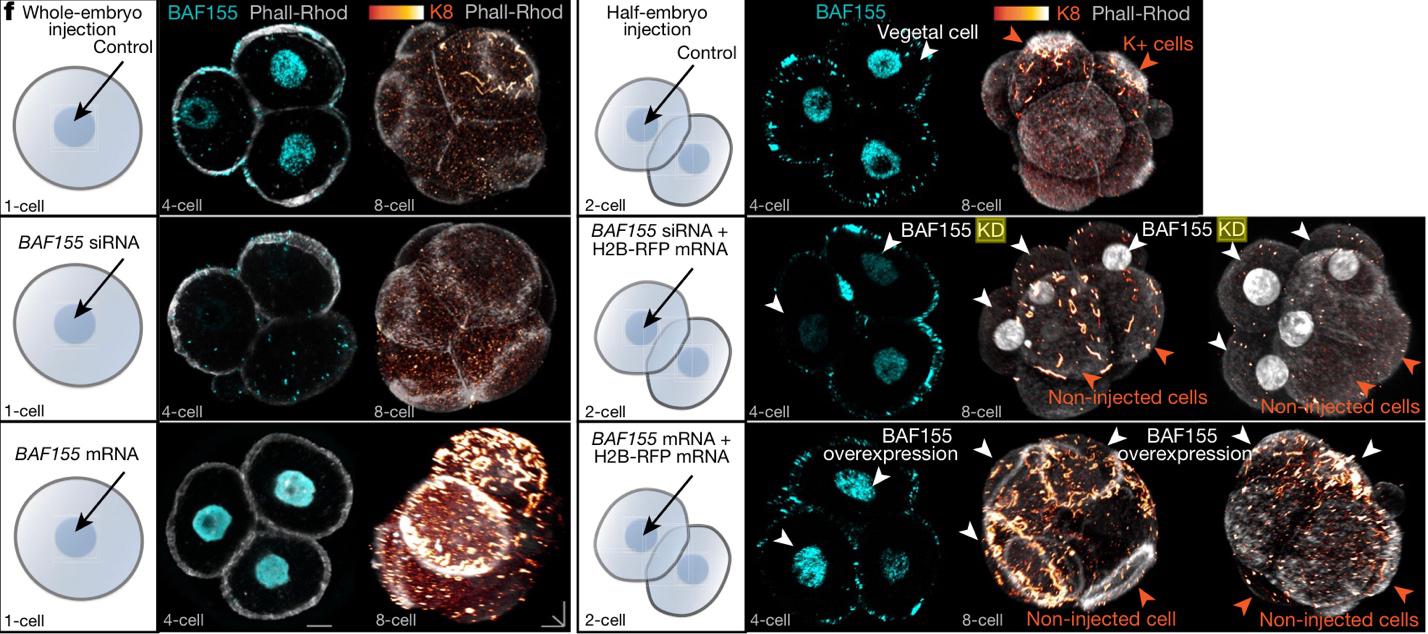
Рисунок 6. Влияние экспрессии BAF155 на экспрессию кератинов
Таким образом, в результате исследования была показана роль кератиновых филаментов в детерминации клеток трофэктодермы на стадиях, предшествующих стадии бластоцисты. При формировании кортикального домена кератиновые филаменты заякориваются в нём при помощи компонентов десмосом. Образование кортикального домена и концентрирование кератиновых филаментов координирует актиновый цитокселет. В ходе митоза, несмотря на деградацию компонентов десмосом, происходит асимметричное наследование кератиновых филаментов благодаря задерживающим свойствам сети актиновых филаментов (большинсто кератинов получает внешняя клетка). Кератин-положительные клетки демонстрируют признаки спецификации трофэктодермы (повышены Yap и CDX2, понижен Nanog), что указывает на роль кератинов в качестве регулятора спецификации. Кератин-положительные клетки в основном являются потомками вегетативного бластомера 4-клеточного эмбриона, в котором происходит BAF155-зависимый синтез кератинов.
Источники:
- Lim HYG, Alvarez YD, Gasnier M, et al. Keratins are asymmetrically inherited fate determinants in the mammalian embryo. Nature. 2020;10.1038, s41586-020-2647-4
- Cockburn, K., & Rossant, J. (2010). Making the blastocyst: lessons from the mouse. Journal of Clinical Investigation, 120(4), 995–1003
Новость подготовил © Муромцев А.В.
03.11.2020