Вопрос о том, каким образом в процессе развития формируется разнообразие нейронов, которое лежит в основе функционирования нервной системы, является одним из главных в нейробиологии. Механизмы, отвечающие за разнообразие нейронов, остаются в значительной степени неизвестными. В прошлом нейроны различали по морфологическим (наличие аксонов/дендритов) признакам, биохимическим (выбор нейротрансмиттера) и физиологическим (различные ионные каналы и свойства мембран) свойствам. Так были идентифицированы классы и подтипы двигательных нейронов, интернейронов, сенсорных и пептидергических нейронов, но вопрос о том, сколько всего существует уникальных типов нейронов и какой вклад каждый из них вносит в работу ЦНС, остался открытым.
В данной статье исследователи используют метод секвенирования РНК отдельных клеток (scRNA-seq), чтобы составить более полный список профилей экспрессии генов в отдельных нейронах на разных стадиях развития нервной системы дрозофилы.Ранее у этого объекта scRNA-seq анализ нейронов был проведён на мозге имаго, куколках, личинках и эмбрионах на стадии бластодермы. Эти эксперименты предоставили ценную информацию о количестве различных типов нейронов и позволили идентифицировать гены-кандидаты в регуляторы формирования связей между подтипами нейронов. Однако ни одно исследование на сегодняшний день не было сосредоточено на идентификации и характеристике транскрипционного разнообразия нейральных клеток-предшественников, и ни одно исследование не картировало их профиль транскрипции на разных стадиях развития личинки.
Авторы этой статьи участвовали в создании Атласа транскриптома клеток нервной системы личинок дрозофилы (см. новость Симоновой О.Б. от 05.09.2022). В нём предоставлена информация о 97 845 клетках, выделенных из тканей мозга 1-часовых, 24-часовых и 48-часовых личинок, они объединены в типовые кластеры клеток: нейральные клетки-предшественники, глиальные клетки, зрелые нейроны, в том числе довольно редкие (например, нейросекреторные клетки или клетки, продуцирующие инсулин). В данном же исследовании авторы идентифицируют несколько подтипов клеток-предшественников с дифференциальной экспрессией генов на разных стадиях развития личинки, с целью определить маркерные гены-кандидаты, специфичные для каждого типа клеток, и их функциональную роль в развитии.
Нейробласты – стволовые нервные клетки. Стоит отменить, что выделяют несколько типов нейробластов. Нейробласты I типа в результате деления формируют самовозобновляющийся нейробласт и “ганглиозную материнскую клетку” (ГМК). Дочерние ГМК могут делиться как симметрично (образуя 2 нейрона или 2 глиальные клетки), так и асимметрично – образуя клетки обоих типов. Нейробласты II типа делятся асимметрично, образуя небольшую клетку – промежуточный предшественник (ПП), у которого во время созревания происходит серия изменений транскрипционной активности. Далее зрелый ПП делится асимметрично 4–6 раз, формируя несколько ГМК, которые производят по два нейрона. Но сначала, на поздних эмбриональных стадиях, нейробласты входят в состояние покоя, из которого они выходят на стадии личинки первого возраста и определить эту стадию трудно, по причине отсутствия специфических маркеров. Авторы статьи обнаружили, что транскриптомы покоящихся нейробластов образуют отдельный кластер и, таким образом, впервые смогли идентифицировать их маркер. Им оказался РНК-связывающий белок Lin-28, экспрессирующийся в нейробластах на ранних личиночных стадиях.
Известно, что за состояние покоя нейробластов и их реактивацию отвечает глия, которая секретирует особые сигнальные молекулы. Оказалось, что уровень и время их экспрессии меняется в разных типах глии ранних личинок. Например, секретируемый гликопротеин Ana, который ингибирует пролиферацию нейробластов, повышался в глии кортекса через 1 час после вылупления личинки из яйца. Инсулиноподобные пептиды (Ilps), способствующие выходу нейробластов из состояния покоя, повышались в глии (кортекса и субпериневральной) глии через 24 и 48 часов. Секретируемая молекула Тrol, способствующая пролиферации нейробластов, активировалась в периневральной глии через 24 часа. Также авторы исследовали наличие в этих нейробластах двух предполагаемых ключевых регуляторов их состояния покоя: инсулиновый рецептор (InR) и транскрипционный фактор Foxo (Forkhead box). Оба белка были сконцентрированы в покоящихся нейробластах у только что вылупившихся личинок. Их экспрессия совпадала с маркером прогениторных клеток - Deadpan; (Dpn) (Рисунок 1, слева). Оказалось, что покоящиеся нейробласты экспрессируют некоторые, но не все, элементы пути передачи сигналов инсулина (Рисунок 1, справа).
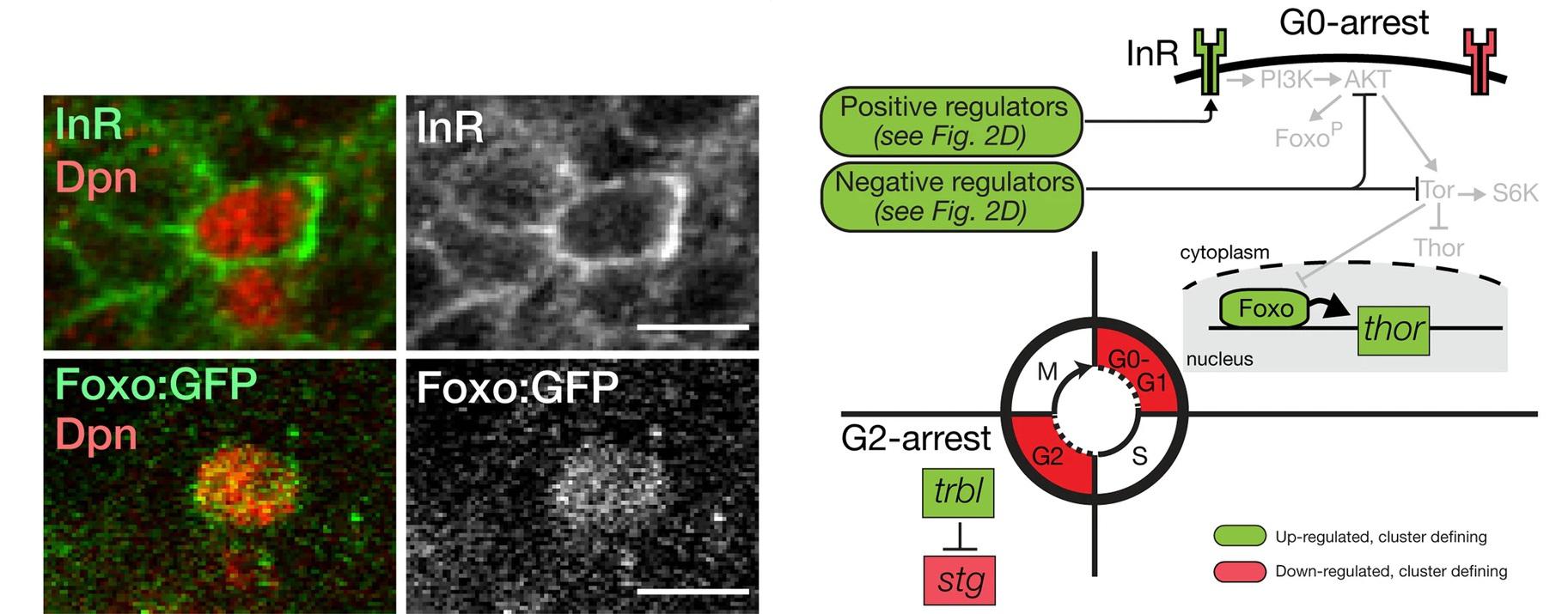
Рис. 1.
Доказательство экспрессии InR и Foxo в покоящихся Dpn-позитивных нейробластах. Масштабная полоса - 5 мкМ (слева). Модель, изображающая гены клеточного цикла и роста, идентифицированные как значительно обогащенные или истощенные в кластере покоящихся нейробластов через 1ч после вылупления личинки (справа).
Таким образом, доказывается модель, в которой глия кортекса во время раннего личиночного развития экспрессирует ген ana для поддержания покоящихся нейробластов, в то время как периневральная поверхностная глия активирует trol, сигнализируя о выходе из состояния покоя. Однако исследователи отмечают, что необходимы дополнительные проверки, действительно ли эти подтипы глии ответственны за регуляцию состояния покоя нейробластов.
В 1-часовых ЦНС личинок нейробласты всё ещё находятся в состоянии покоя. К 24 часам нейробласты типа II выходят из состояния покоя и генерируют промежуточные клетки-предшественники ПП. В ПП включается дополнительный каскад временных факторов транскрипции (temporal transcription factors ‒ TTF) перед их делением на дочерние ГМК. В исследовании поднимается вопрос о том, используют ли ПП и нейробласты типа I один и тот же каскад TTF, учитывая их функциональное сходство (оба производят ГМК). Авторы выдвигают предположение, что вероятно наличие общих TTF, но также ожидаемы различия в транскрипции, которые можно было бы проверить по специфичности функций этих типов клеток.
Переход от ГМК к постмитотическим нейронам знаменует важный этап в развитии клетки. Авторы заметили, что гены, определяющие кластер ГМК, широко экспрессировались в клетках-предшественниках, в то время как маркерные гены, определяющие молодые сформированные нейроны, широко экспрессировались в незрелых нейронах. Например, кластер ГМК был определён по экспрессии гена cas, который также экспрессировался в нейробластах; поэтому исследователи считают, что следует пересмотреть функциональную роль cas в развитии ГМК, учитывая, что найденные гены-кандидаты представляют собой транскрипты, а не белки; и вполне вероятно имеют разные паттерны для многих генов из-за посттранскрипционной регуляции.
Незрелые нейроны плохо описаны в литературе и имеют мало канонических маркеров. С помощью анализа, проведённого в данном исследовании, были обнаружены маркеры-кандидаты, которые могут восполнить этот пробел. Любопытно, что незрелые нейроны, упоминаемые в статье, формировали шесть кластеров; тем не менее, их определили, как один тип клеток. Таким образом, каждый из шести кластеров незрелых нейронов может представлять дискретные состояния дифференцировки внутри незрелых нейронов. И напротив, каждый кластер может представлять линию нейробластов, специфическую для определённого сегмента или органа (например, центральный мозг или вентральный нервный ствол).
Зрелые нейроны были тщательно изучены по экспрессии их уникальных нейротрансмиттеров, были выявлены их редкие подтипы и обнаружены значительные изменения в экспрессии генов на раннем этапе развития личинок. В частности, один кластер нейронов экспрессируется только через 24 часа после вылупления личинки, а другой кластер нейронов экспрессируется только через 48 часов (Рисунок 2).
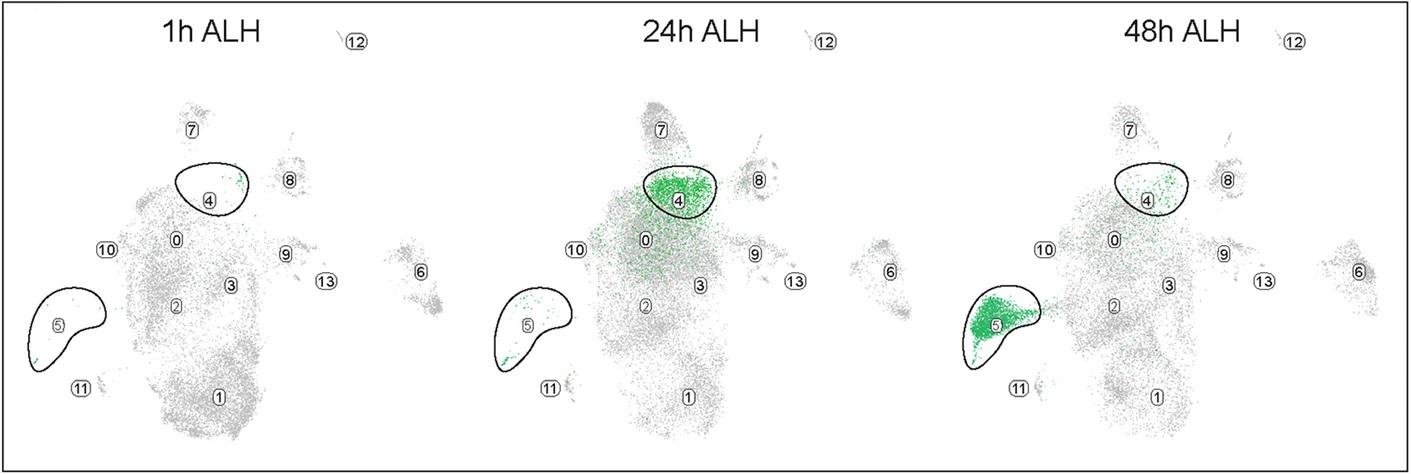
Рис. 2.
UMAP (U-карта) атласа транскриптов от 1 до 48 часов от вылупления личинок (after larval hatching ‒ALH), кластеры 4 и 5 обведены линией.
Авторы предполагают, что эти скопления представляют собой нейроны, образованные и, следовательно, претерпевшие дифференцировку в разное время, что в свою очередь говорит о том, что нейроны личинок дифференцируются асинхронно. Было отмечено, что наиболее значительные изменения произошли между 1 и 24 часами. Удивительно, что многие гены, кодирующие белки «зрелых» нейронов, активировались через 1 час после вылупления личинки. Например, различные рецепторы нейротрансмиттеров и молекулы синаптической связи Nlg2 и Nlg3. Вероятно, это связано с наличием дифференцированных нейронов эмбрионального происхождения через 1 ч после вылупления личинок. Эти данные свидетельствуют о том, что химические связи между нейронами, в которых нейрон посылает информацию, секретируя нейротрансмиттер, сохраняется от поздних эмбрионов до только что вылупившихся личинок.
Хотя большая часть генома дрозофилы была тщательно изучена, остаётся много не охарактеризованных генов. Используя анализ scRNA-seq исследователи могут выдвигать проверяемые гипотезы о функции генов, основанные на экспрессии генов, специфичных для типа клеток, или их совместной экспрессии с генами с известной функцией. Также в данном исследовании было обнаружено много до сих пор не описанных генов с экспрессией, специфичной для типа клеток, а также длинные некодирующие РНК, что несомненно даст новое представление о развитии и функционировании ЦНС.
Новость подготовила ©Куваева Е.Е.
03.10.2022
