Научные интересы: нейронауки, физиология центральной нервной системы, поведенческие модели.
Образование новых нейронов в мозгу во взрослом возрасте – это очень локальный и малоактивный процесс, протекающий у высших млекопитающих, в том числе приматов, в основном в зоне зубчатой извилины гиппокампа и субвентрикулярной области. Гиппокампальный нейрогенез (ГН) стал предметом недавнего исследования группы Wu и др. [1], опубликованной в Nature Aging. Эта работа существенно расширяет представления о ГН, поскольку в ней не только показана динамика этого процесса с возрастом, но и подробно исследованы причины наблюдаемых изменений. Методы вроде ИГХ или РНК-секвенирования не позволяют изучить динамику клеточных процессов при ГН, поэтому серьезным достоинством работы является прижизненное отслеживание популяции нейрональных стволовых клеток. Это позволило получить не только количественные характеристики динамики популяции, но и проследить судьбу индивидуальных клеток – количество делений, путь миграции, пролиферативную активность и момент гибели.
Гиппокамп мыши, https://www.frontiersin.org/...
Понимание этих процессов важно в практическом аспекте, поскольку управление нейрогенезом могло бы теоретически стать подходом к терапии нейродегенеративных заболеваний (НДЗ). А самым распространенным НДЗ является болезнь Альцгеймера, которая вызывает дегенерацию нейронов в том числе в самом гиппокампе. Одна из основополагающих работ по изучению динамики ГН у людей использовала оригинальный подход в виде сравнительного анализа содержания изотопа 14С в ДНК гиппокампальных нейронов у людей разных возрастов [2]. Содержание этого изотопа в природе менялось на протяжении ХХ века в результате проведения и последующего запрета ядерных испытаний, а накопление в ДНК нейронов указывает на его захват из окружающей среды в процессе нейрогенеза. Благодаря анализу динамики этого накопления удалось оценить скорость ГН в приблизительно 700 нейронов/сутки. Тем не менее, этих данных недостаточно для описания динамики ГН и работы вовлеченных в этот процесс клеточных механизмов, что для разработки терапии на основе управляемого усиления нейрогенеза.
Расширением понимания клеточных процессов в ГН и занялись авторы обсуждаемой работы в Nature Aging. Они использовали мечение ДНК и прижизненную визуализацию, чтобы проследить судьбу индивидуальных стволовых и дочерних клеток в их гиппокампальной нише в течение жизни животного. Исходя из того, что после 2-месячного возраста темпы ГН у грызунов падают, выходя на постоянный уровень после 8 месяцев жизни, авторы работы провели сравнительный анализ состояния ГН у мышей двух возрастов: 2 и 12 месяцев. Задачами исследования было определить клеточную судьбу отдельных стволовых клеток, количество дочерних клеток и созревающих нейронов, соотношение пролиферирующих и покоящихся клеток-предшественников.
На трансгенных Nestin-GFP-мышах был охарактеризован пул нейрональных стволовых клеток (НСК). Количество радиально-глиально-подобных (Р)-НСК и не-Р-НСК снижалось к возрасту 12 месяцев, как и доля пролиферирующих НСК в целом.
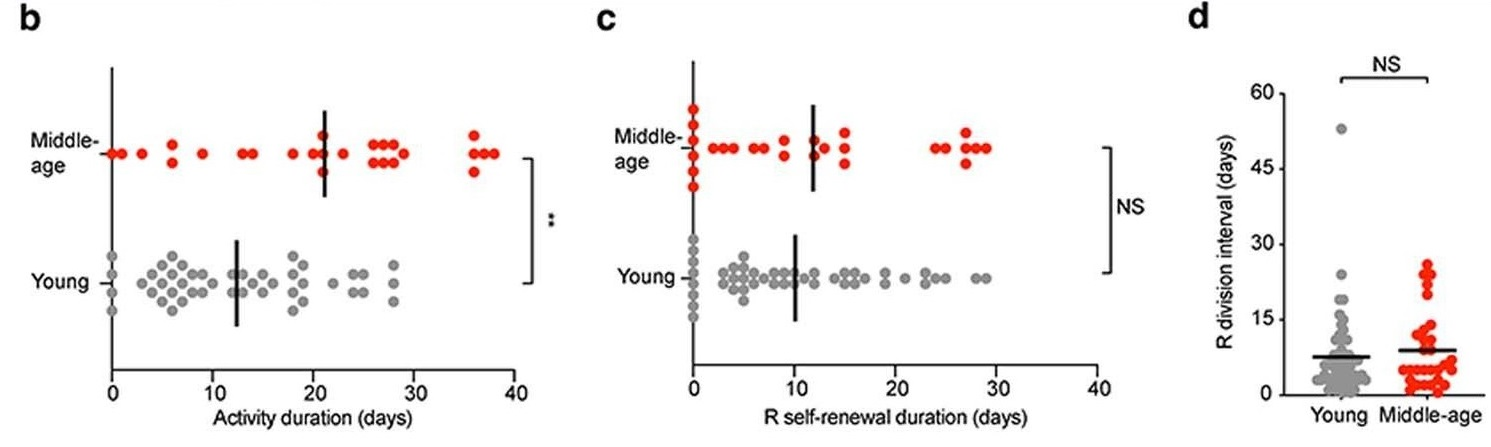
Рис. 1. Сравнение у двухмесячных и годовалых мышей: b) длительности фазы активной пролиферации нейрональных стволовых клеток; c) времени самообновления стволовых клеток; d) интервала времени между делениями.
Далее исследование вели на трансгенных животных, у которых Р-НСК визуализировали при помощи tdTomato-репортера методом прижизненной двухфотонной микроскопии. Р-НСК первично обнаруживали по наличию однозначно идентифицируемого радиального отростка. Несмотря на то, что большая часть Р-НСК оставалась в покоящемся состоянии в обеих возрастных группах, пул пролиферирующих Р-НСК существенно уменьшался по достижении 12 месяцев (Рис. 1 b-d), что совпадало с данными по снижению активации Р-НСК, полученными на Nestin-GFP линии мышей. Также популяция поколения дочерних клеток у отдельных НСК заметно снижалась в возрастной группе по сравнению с молодыми животными.
Чтобы выявить причины этого, авторы проследили судьбу отдельных Р-НСК. Они обнаружили, что длительность активной фазы, когда клетки готовы к пролиферации, повышается с возрастом, а интервал между делениями увеличивается. Также у мышей в возрастной группе 12 месяцев наблюдали трехкратное увеличение доли Р-НСК, переходящих в длительное (более 1 месяца) неактивное состояние после фазы пролиферации, которые авторы назвали «покоящимися» Р-НСК. При этом у двухмесячных животных такие клетки проходили одну фазу деления, в то время как у годовалых – три, перед тем, как перейти в фазу покоя. При этом не было обнаружено каких-либо различий в длительности или скорости миграции изучаемых клеток в зависимости от возраста мышей.
Важным наблюдением также стало определение момента гибели клеток-предшественников, приводящее к уменьшению популяции дочерних клеток и снижению нейрогенеза. Было определено два основных срока клеточной гибели – в течение первых 7 дней после формирования новой клетки и позже, на 10-13 дни. Именно на первом сроке у 12-месячных мышей увеличивались темпы гибели Р-НСК, по сравнению с 2-месячными (Рис. 2 а-с).
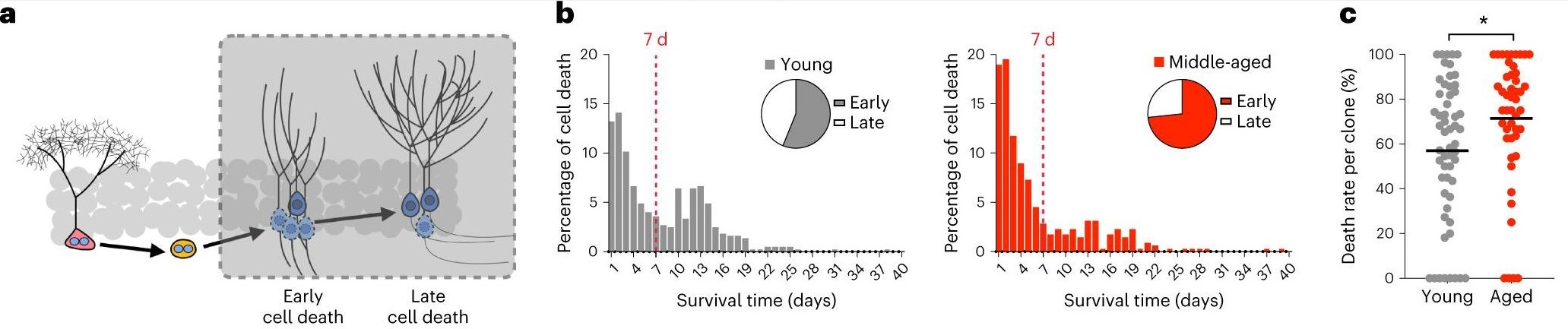
Рис. 2. Клеточная судьба нейрональных стволовых клеток (а), их доля по возрасту, погибающая у мышей изученных групп (b) и доля гибнущих дочерних клеток (с)
В целом, исследователи пришли к следующим выводам. Увеличение темпов клеточной гибели в первые дни развития НСК по мере старения организма является ключевой причиной снижения темпов нейрогенеза у мышей по достижении 12-14-месячного возраста. В то же время темпы деления НСК в позднем возрасте начинают меньше истощать их собственный пул, и заметно большая доля этих клеток переходит в неактивное, «покоящееся» состояние.
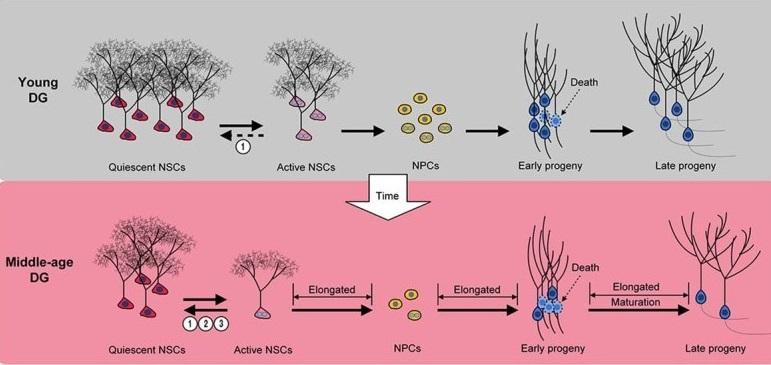
Рис. 3. Основные выявленные в работе различия в нейрогенезе между двумя возрастными группами мышей
В целом, ГН является перспективным для разработки терапевтических подходов для лечения НДЗ. Главным преимуществом ГН является то, что это – естественный эндогенный процесс, в отличие от хирургического вмешательства или пересадки стволовых клеток. Разработка терапевтических подходов к лечению НДЗ с использованием, к примеру, полюрипотентных стволовых клеток, до сих пор не может решить всех проблем, стоящих на пути внедрения этой технологии. Поэтому фундаментальная разработка всех возможных подходов к борьбе с нейродегенеративными процессами остается актуальной проблемой. Понимание динамики ГН важно для того, чтобы научиться делать этот процесс управляемым. На основании своих данных авторы работы отмечают, что перспективная терапия использованием ГН должна быть сосредоточена не только на стимуляции клеточной пролиферации и дифференцировки, но и на замедление гибели клеток-предшественников ради увеличения количества дочерних клеток.
Права на использование рисунков и данных определены авторами оригинальной статьи в соответствии со свободной лицензией https://creativecommons.org/...
[1] Wu Y, Bottes S, Fisch R, Zehnder C, Cole JD, Pilz GA, Helmchen F, Simons BD, Jessberger S. Chronic in vivo imaging defines age-dependent alterations of neurogenesis in the mouse hippocampus. Nat Aging. 2023 Apr;3(4):380-390. doi: 10.1038/s43587-023-00370-9
[2] Spalding KL, Bergmann O, Alkass K, Bernard S, Salehpour M, Huttner HB, Boström E, Westerlund I, Vial C, Buchholz BA, Possnert G, Mash DC, Druid H, Frisén J. Dynamics of hippocampal neurogenesis in adult humans. Cell. 2013 Jun 6;153(6):1219-1227. doi: 10.1016/j.cell.2013.05.002
Новость подготовил
© Богданов В.В.
03.07.2023