 © Паюшина Ольга Викторовна
старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
© Паюшина Ольга Викторовна
старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
Тенденция к увеличению продолжительности жизни человека, наблюдаемая в последнее время и прогнозируемая в обозримом будущем, поднимает проблему возрастных заболеваний и порождает потребность в поиске способов продления активного долголетия. Как известно, одна из основных теорий старения организма связывает его с накоплением в клетках молекулярных повреждений, возникающих с возрастом или под действием стрессов. Если механизмы репарации ДНК не справляются с восстановлением этих повреждений, клетки могут приобретать характеристики стареющих – выходить из цикла и постоянно секретировать провоспалительные цитокины. Очевидно, в появлении клеток с таким фенотипом есть определенный биологический смысл – в частности, вызываемое ими воспаление может способствовать заживлению ран. Однако стареющие клетки становятся устойчивы к апоптозу, из-за чего с течением времени накапливаются в тканях, нарушая их функции. Авторы статьи поставили цель выяснить, каким образом подобные клетки избегают гибели и как можно преодолеть эту проблему. Сравнив активность генов в нормальных и состаренных облучением фибробластах человека, они обнаружили, что облученные клетки предрасположены к апоптозу, но его осуществление сдерживается фактором транскрипции FOXO4, экспрессия которого в стареющих клетках существенно усилена. FOXO4 локализуется в их ядрах, где связывает проапоптотический белок p53. Проанализировав полученные данные, авторы предположили, что нарушение взаимодействия FOXO4 с p53 способно избирательно активировать апоптотическую программу в стареющих клетках, не затрагивая нормальные.
Для проверки этой гипотезы они создали пептид FOXO4-DRI, который по своей структуре соответствует участку FOXO4, связывающемуся с p53, и способен вытеснять из комплекса с последним эндогенный FOXO4. Было показано, что при добавлении этого пептида к стареющим облученным фибробластам активная форма p53 выходит из ядер в цитозоль и индуцирует апоптоз по внутреннему (митохондриальному) сигнальному пути через каспазы 3/7. На жизнеспособность необлученных клеток FOXO4-DRI не влияет.
Таким образом, пептид FOXO4-DRI продемонстрировал свою эффективность в селективном уничтожении стареющих клеток in vitro. Его способность восстанавливать нарушенный гомеостаз тканей in vivo была протестирована на трех экспериментальных моделях: индуцированного химиотерапевтическим препаратом доксорубицином поражения печени, ускоренного и естественного старения. Инъекции доксорубицина мышам приводили к накоплению в печени стареющих клеток, выявляемых по экспрессии гена p16 и продуцирующих провоспалительный цитокин ИЛ-6. При этом у животных наблюдались снижение массы тела и выход в кровь аспартатаминотрансферазы (АСТ) – маркера повреждения печени. Введение FOXO4-DRI нейтрализовало эти эффекты. Другой моделью служили преждевременно стареющие мутантные мыши XpdTTD/TTD, которые уже в молодом возрасте начинают терять шерсть, демонстрируют менее активное по сравнению с нормальными животными поведение и имеют сниженную функцию почек. После введения пептида в организме таких мышей становилось меньше стареющих клеток, у них повышалась плотность волосяного покрова и уменьшались признаки общей слабости – в частности, животные активнее обследовали окрестности и пробегали большее расстояние в беговом колесе. Улучшалось и состояние почек: в крови снижалось содержание мочевины, а в почечных канальцах – уровень экспрессии ИЛ-6. И, наконец, было оценено влияние FOXO4-DRI на процесс старения нормальных мышей. Эксперименты затруднялись тем, что скорость старения (и на клеточном, и на организменном уровне) у разных особей сильно варьировала, что не позволило, в частности, достоверно оценить влияние пептида на их активность в беговом колесе. Однако было показано, что у этих мышей, как и у XpdTTD/TTD, он уменьшает количество стареющих клеток, повышает плотность шерсти и восстанавливает сниженную функцию почек. Таким образом, FOXO4-DRI оказывает благотворное влияние на организм не только при генетически ускоренном старении, но и при нормальном, что придает его изучению особую актуальность с точки зрения возможного клинического применения.
Рассматриваемая работа – уже не первая попытка улучшить функционирование тканей, выборочно удаляя из них клетки с признаками старения. Ранее аналогичные результаты были получены путем введения в организм мыши генетической конструкции для элиминации клеток, экспрессирующих p16 (Baker D.J., Childs B.G., Durik M. et al. «Naturally occurring p16Ink4a-positive cells shorten healthy lifespan» Nature, 2016, 530: 184–189), однако этот подход трудно перенести в клинику. Уничтожению стареющих клеток способствуют также ряд препаратов, известных как сенолитики (кверцитин, дазатиниб и ингибиторы противоапаптотических белков семейства BCL) (Zhu Y., Tchkonia T., Pirtskhalava T. et al. “The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs” Aging Cell, 2015, 14: 644–658; Chang J., Wang Y., Shao L. et al. “Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice” Nat. Med., 2016, 22: 78–83), которые, впрочем, влияют также и на нормальные клетки. Пептид FOXO4-DRI обладает более специфичным действием и не оказывает побочных эффектов, свойственных другим средствам против старения (в частности, не вызывает тромбоцитопении), что позволяет надеяться на его успешное использование для восстановления здоровья пожилых людей. Авторы не исключают того, что он может оказаться полезен и в борьбе с онкологическими заболеваниями, поскольку секретируемые стареющими клетками провоспалительные факторы способны усиливать «стволовость» и миграционную способность раковых клеток. Безусловно, оценка пригодности этого пептида для клинического использования и определение сферы его возможного применения требуют глубокого и всестороннего исследования. Однако первые результаты экспериментов на животных, представленные в данной статье, выглядят весьма обнадеживающими.
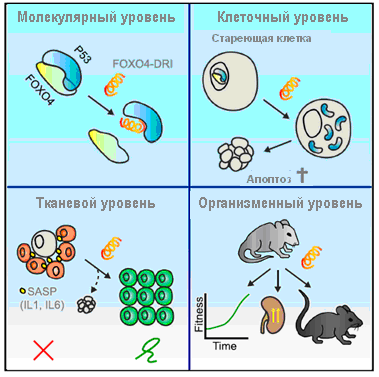
Рисунок. Механизмы сенолитического эффекта пептида FOXO4-DRI.
Новость подготовила © Паюшина О.В.
03.04.2017