Эндометрий - внутренняя оболочка матки - обладает исключительной динамичностью, демонстрируя морфологические и функциональные преобразования в течение репродуктивного цикла и беременности. Эти процессы требуют тонкой настройки межклеточных взаимодействий, которая осуществляется половыми стероидными гормонами (Makieva et al., 2018). На настоящий момент существуют данные о том, что эндометрий обладает выраженной гетерогенностью и содержит пул стромальных клеток, отвечающих за индукцию пролиферации и восстановления ткани (Ma et al., 2020, Li et al., 2024). Однако физиологическая роль клеток, несущих прогениторные маркеры, редко рассматривается в исследованиях, поскольку на настоящий момент интерес смещен в сторону стволовых свойств, обеспечивающих регенерацию того или иного органа.
В эндометрии человека экспрессия CD90, маркера мезенхимных стволовых клеток, охватывает весь стромальный компартмент функционального слоя, а также обнаруживается в базальном слое в периваскулярном пространстве (Schwab et al., 2008). У мыши CD90+ клетки выявляются в строме, прилегающей к эпителию (Memarzadeh et al., 2010). Широкое распространение данного маркера в эндометрии предполагает наличие особого функционала несущих его клеток. В этом исследовании провели серию экспериментов, результаты которых раскрывают роль CD90+ стромальных клеток в процессах децидуализации и имплантации.
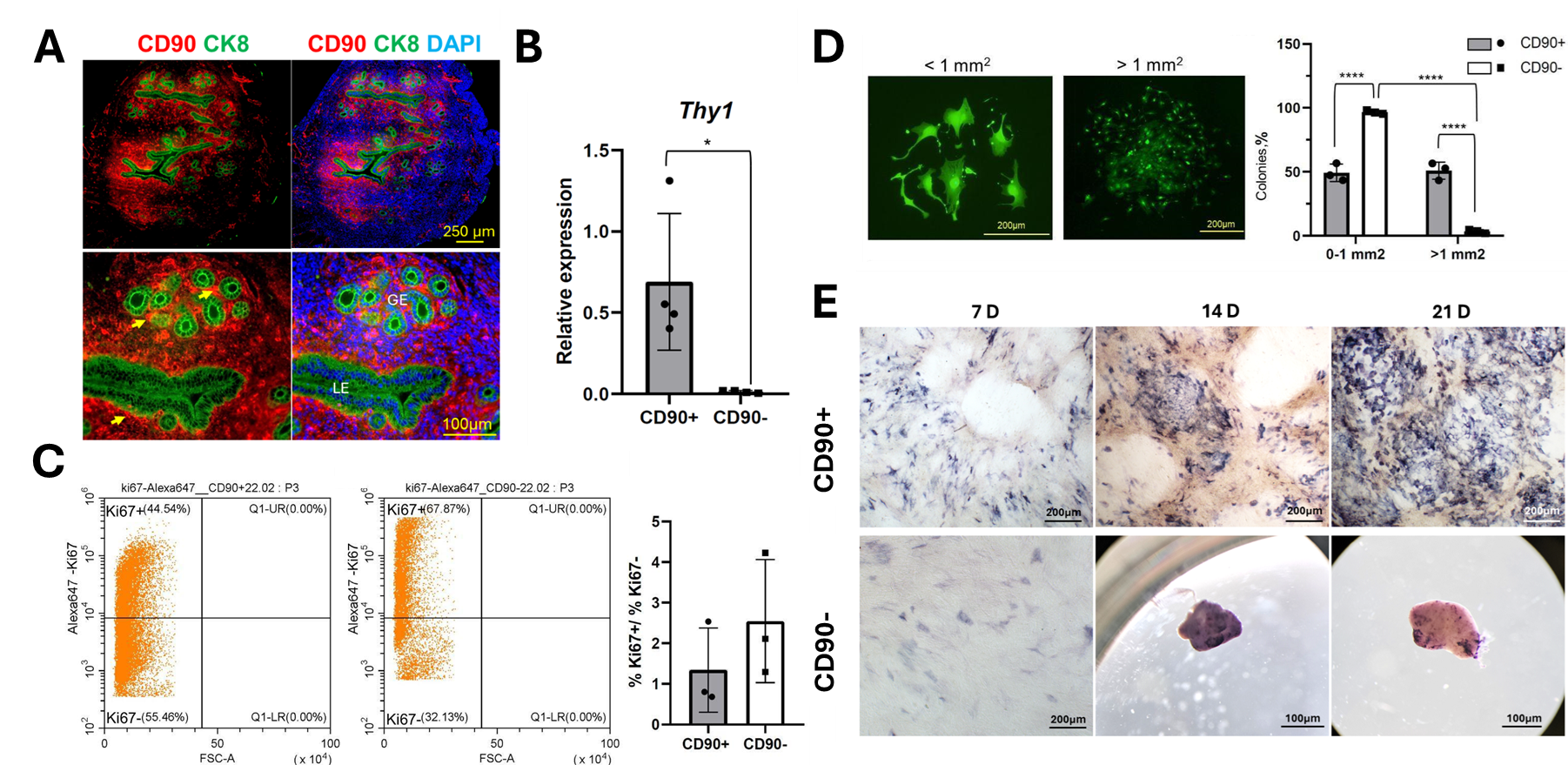
Крупное скопление CD90+ клеток обнаруживается под люминальным эпителием, что указывает на их возможное участие в подготовке эндометрия к взаимодействию с эмбрионом (Рис. 1A). Используя флуоресцентно-активированный клеточный сортинг (FACS), мы выделили популяцию CD90+ клеток и подтвердили их фенотип с помощью анализа экспрессии гена Thy1 (Рис. 1B). Функциональные тесты показали, что эти клетки обладают более высокой способностью к колониеобразованию, формируя более крупные колонии относительно CD90- клеток (Рис. 1C). Однако их пролиферативная активность в культуре оказалась ниже, чем у CD90- клеток (Рис. 1D). Кроме того, CD90+ клетки продемонстрировали высокую эффективность остеогенной дифференцировки (Рис.1 E). Эти данные подтверждают, что CD90+ клетки обладают прогениторными свойствами, которые могут играть ключевую роль в поддержании тканевого гомеостаза.
Рисунок 1. Выделение популяций CD90+ и CD90- клеток и оценка их пролиферативной и колониеобразующей активности. (A) Иммунофлуоресцентные изображения матки небеременной мыши, зеленый - цитокератин 8 (CK8), красный - CD90, синий - DAPI. Стрелками указаны CD90+ клетки, окружающие железистый (GE) и люминальный (LE) эпителий. (B) Гистограмма уровня экспрессии мРНК Thy1 после сортировки CD90+ и CD90- клеток методом FACS. Экспрессия гена была нормализована по отношению к генам домашнего хозяйства, Actb и Tbp. Paired t-test, * - p<0,05. (C) Проточная цитометрия Ki67+ и Ki67- клеток в культурах CD90+ и CD90- клеток и гистограмма, отражающая процентное соотношение Ki67+ to Ki67- клеток в культурах CD90+ и CD90- клеток. (D) Общий вид колоний, окрашенных кальцеином (H) Гистограмма, отражающая процентное соотношение колоний площадью 0-1 мм2 и более 1 мм2 в обеих культурах. One-way ANOVA followed by Sidak’s test, **** - p<0,0001. (E) Световая микроскопия остеогенной дифференцировки СD90+ и CD90- клеток: окрашивание на щелочную фосфатазу. 7 D, 14 D, 21 D - дни дифференцировки.
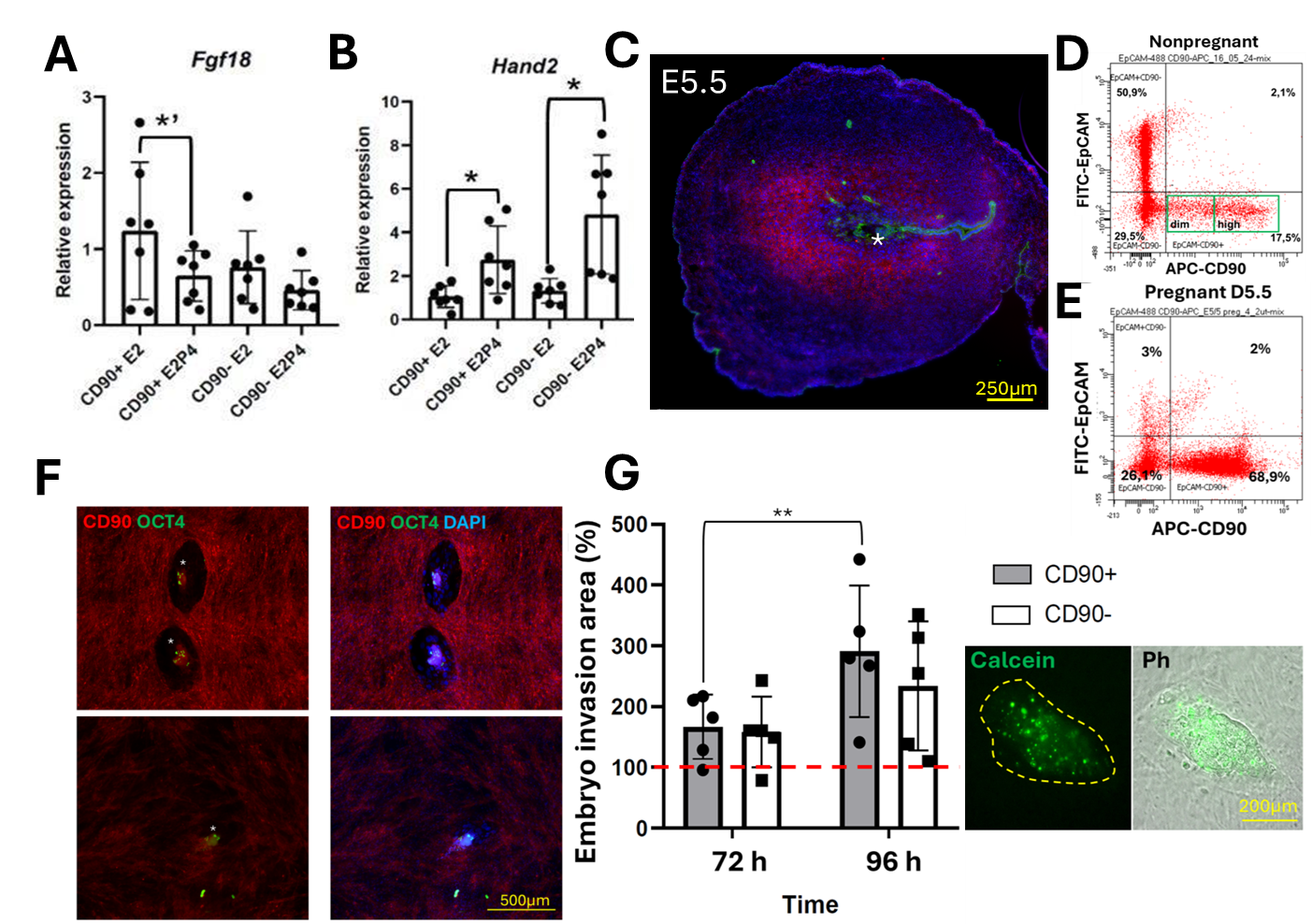
В работе получены данные, которые подтверждают, что CD90+ клетки реагируют на гормональные стимулы, демонстрируя изменения в экспрессии эстрадиол-зависимых генов и маркеров децидуализации, зависящих от прогестерона. Так, экспрессия Fgf18, который стимулируется эстрадиолом, снижалась в условиях индукции децидуализации (Рис. 2A). Также наблюдалось увеличение экспрессии маркеров децидуализации (Hand2 и Prl) в ответ на прогестерон, что подтверждает способность CD90+ клеток участвовать в подготовке эндометрия к беременности (Рис. 2B).
Для изучения роли CD90+ клеток в имплантации эмбриона авторы статьи провели эксперименты in vivo и in vitro. В матке беременной мыши процент CD90+ клеток значительно увеличивался по сравнению с небеременной, причем клетки были организованы вокруг имплантирующегося эмбриона (Рис. 2C, D, E). В условиях совместного культивирования с эмбрионами CD90+ клетки продемонстрировали большую способность к взаимодействию с бластоцистой относительно CD90- клеток, что выражалось в значительном увеличении площади инвазии эмбриона клеточный монослой (Рис. 2F, G). Таким образом, CD90+ клетки могут контролировать имплантацию эмбриона.
Рисунок 2. Гормональная регуляция CD90+ и CD90- клеток в условиях in vitro. Взаимодействие эмбриона со CD90+ и CD90- популяциями стромы эндометрия in vivo и in vitro. (A) Гистограмма уровней экспрессии Fgf18, (B) Hand2 в культурах CD90+ и CD90- после гормональных воздействий. Экспрессия генов нормализована на два гена домашнего хозяйства - Actb и Tbp. One-way ANOVA followed by Sidak’s test, * - p<0,05. One-way ANOVA followed by Fisher’s LSD test, *’ - p<0,05. (C) Иммуногистохимическое окрашивание матки мыши на D5.5. красный - CD90, зеленый - cytokeratin 8 (CK8), синий - DAPI. * - место имплантации эмбриона. (D,E) Анализ тотальной фракции клеток эндометрия небеременной и беременной мыши на стадии E5.5 методом проточной цитофлуориметрии. (F) Иммуноцитохимическое окрашивание культур CD90+ и CD90- после 96h с момента помещения эмбрионов в культуру. * - эмбрион. Red - CD90, зеленый - OCT4, синий - DAPI. (G) Гистограмма изменения площади распластывания эмбрионов мыши на 72h и 96h с начала распластывания эмбриона на клетках CD90+ и CD90-. Красная пунктирная линия - площадь эмбрионов на 48h культивирования, равная 100%. Two-way ANOVA followed by Sidak’s test, ** - p<0,01. Фазовый контраст (Ph) и иммунофлуоресцентное окрашивание эмбриона, окрашенного Calcein. Желтым пунктиром выделена граница инвазии.
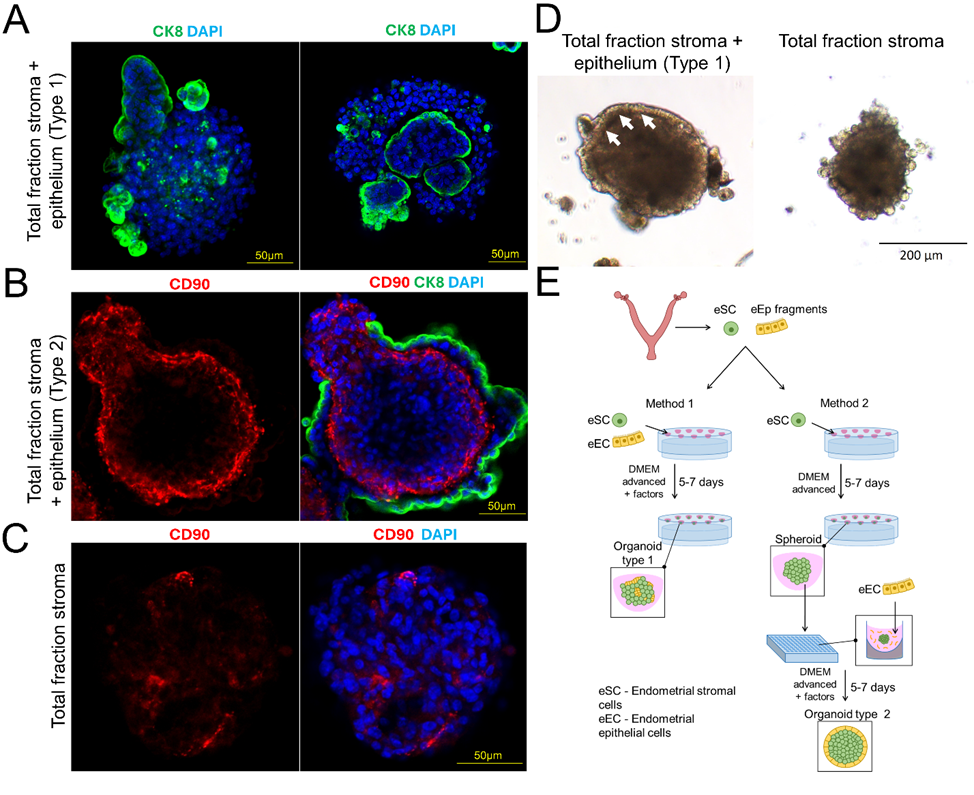
Ключевым результатом работы стало выявление зависимости экспрессии CD90 от контакта с эпителиальным слоем. Для этого были созданы эпителиально-стромальные органоиды с использованием модифицированного двухэтапного подхода (метод 2). В отличие от метода 1, который подразумевает сочетание клеток эпителия и стромы эндометрия в висячей капле (результат на Рис. 3A), метод 2 включает наслаивание эпителия на сфероид из стромы (результат на Рис. 3B). На первом этапе стромальные клетки формировали сфероиды в висячей капле в течение 5-7 дней. На втором этапе сфероиды (Рис. 3C) сочетали с эпителиальными клетками, что обеспечило образование равномерного эпителиального слоя вокруг клеток стромы (Рис. 3B). Такой подход позволил воспроизвести пространственную организацию клеток, характерную для эндометрия, что сделало модель подходящей для изучения межклеточных взаимодействий и роли CD90+ клеток в процессе имплантации.
Рисунок 3. Формирование 3D конструктов. (A) Органоид, образованный из клеток эпителия и тотальной стромы с помощью метода 1. Зеленый - CK8, синий - DAPI. (B) Органоид, образованный из клеток эпителия и тотальной стромы, с помощью метода 2. Красный - CD90, зеленый - CK8, синий - DAPI. (C) Сфероиды из тотальной стромы - первый этап метода 2. Красный - CD90, синий - DAPI. (D) Сфероид из тотальной стромы (а) и органоид из тотальной стромы и клеток эпителия (b), световая микроскопия. (E) Общая схема экспериментов по подбору оптимального метода формирования 3D конструктов (метод 1 и метод 2).
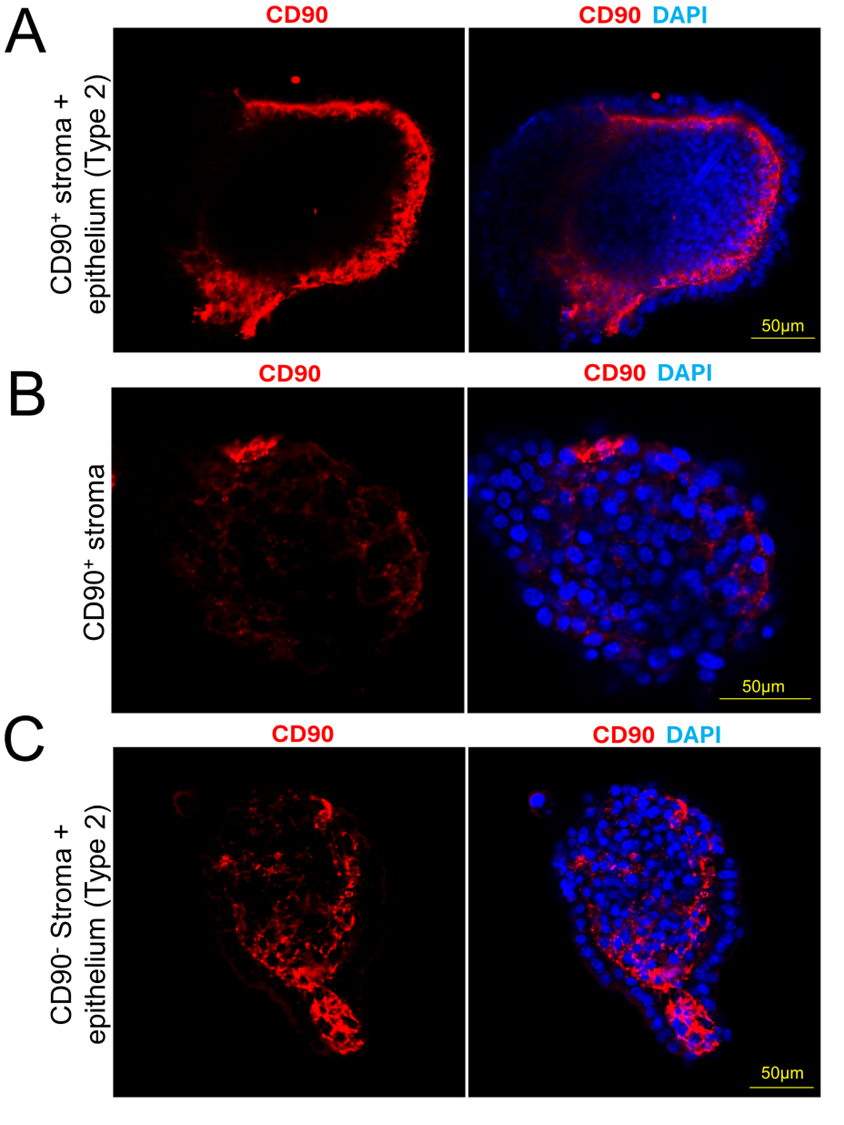
В ходе экспериментов на двух типах эпителиально-стромальных органоидов, сформированных из CD90+ и CD90- клеток, было выявлено, что CD90+ клетки при контакте с эпителием концентрируются непосредственно под эпителиальным слоем (Рис. 4A). Причем экспрессия CD90 поддерживается эпителием, поскольку в сфероидах из CD90+ клеток происходила потеря маркера (Рис. 4B). Более того, в органоидах из CD90- клеток после длительного культивирования под эпителиальным слоем обнаруживались клетки, положительные по CD90 (Рис. 4C).
Рисунок 4. Формирование 3D конструктов из CD90+ и CD90- клеток и клеток эпителия. (А) Органоиды, сформированные из эпителиальных клеток и CD90+ клеток (метод 2). (B) Стромальные сфероиды из CD90+ клеток – первый шаг из метода 2. (C) Органоид, сформированный из эпителиальных клеток и CD90- клеток (метод 2). Красный – CD90, синий – DAPI.
Результаты исследования подтверждают значимость CD90+ клеток в процессах имплантации эмбриона и децидуализации. Эти клетки не только участвуют в гормонально-зависимых перестройках эндометрия, но и играют важную роль в межклеточной коммуникации с эпителием и эмбрионом. Таким образом, CD90+ клетки могут рассматриваться как перспективная мишень для изучения механизмов ранних этапов беременности и разработки терапевтических подходов для лечения бесплодия.
Список литературы
- Makieva S, Giacomini E, Ottolina J, Sanchez AM, Papaleo E & Viganò P 2018 Inside the endometrial cell signaling subway: mind the gap(s). International journal of molecular sciences 19 2477.
- Ma H, Liu M, Li Y, Wang W, Yang K, Lu L, He M, Deng T, Li M & Wu D 2020 Intrauterine transplantation of autologous menstrual blood stem cells increases endometrial thickness and pregnancy potential in patients with refractory intrauterine adhesion. Journal of Obstetrics and Gynaecology Research 46 2347-2355.
- Li Q, Kannan A, DeMayo FJ, Lydon JP, Cooke PS, Yamagishi H, Srivastava D, Bagchi MK & Bagchi IC 2011 The antiproliferative action of progesterone in uterine epithelium is mediated by Hand2. Science 331 912-6.
- Schwab KE, Hutchinson P & Gargett CE 2008 Identification of surface markers for prospective isolation of human endometrial stromal colony-forming cells. Human Reproduction 23 934-943.
- Memarzadeh S, Zong Y, Janzen DM, Goldstein AS, Cheng D, Kurita T, Schafenacker AM, Huang J & Witte ON 2010 Cell-autonomous activation of the PI3-kinase pathway initiates endometrial cancer from adult uterine epithelium. PNAS 107 17298-303.
Новость подготовили
© Александрова Алена Дмитриевна, Гайдамака Анна Олеговна
03.02.2025