Научные интересы: клеточная биология, гемопоэтические стволовые клетки, внеклеточные везикулы, клетки-супрессоры миелоидного происхождения (МДСК), макрофаги, индуцированные плюрипотентные стволовые клетки
Известно, что в нормальном кроветворении и при различных патологиях гемопоэза большую роль играет кроветворная ниша. Получение в условиях in vitro структур, содержащих одновременно и гемопоэтические предшественники, и функциональную клеточную нишу является крайне важной задачей, как с общебиологической точки зрения - для изучения гемопоэза в условиях in vitro, так и с практической точки зрения, для развития в дальнейшем персонализированной медицины.
Группе профессора К. Клейна из Мюнхенского университета имени Людвига и Максимилиана совместно с другими немецкими учеными удалось получить из индуцированных плюрипотентных клеток человека (чиПСК) небольшие органоиды, которые по своим морфологическим и функциональным свойствам во многом повторяли костный мозг (КМ) человека. Метод создания и характеристики полученных органоидов подробно описаны авторами в их недавней, 2024 года, публикации в Nature Methods – «Generation of complex bone marrow organoids from human induced pluripotent stem cells» Frenz-Wiessner et al., 2004, https://doi.org/10.1038/s41592-024-02172-2.
Предложенные в более ранних работах подходы к получению «костномозговых» органоидов предполагали предварительное выделение клеток ниши (мезенхимальных и эндотелиальных) непосредственно из костного мозга человека с последующим созданием органа на чипе или органоидов, содержащих и гемопоэтические предшественники, выделенные из пуповиной крови или костного мозга, и эти клетки ниши (Chou et al., 2020, Giger et al, 2022). Такие методы затруднены крайне маленьким количеством клеток, которые удается выделить, и не подходят для исследований патологий, связанных с кроветворной нишей.
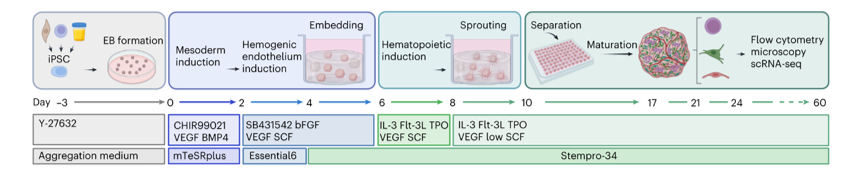
Авторы рассматриваемой публикации подробно описывают свой метод, основанный на предварительном получении эмбриоидных телец из чиПСК и культивировании их xeno-free в коллагеново-матригельном матриксе в 3d условиях в средах, содержащих индукторы дифференцировки в мезодермальном, гемогенно-эндотелиальном и гемопоэтическом направлениях. На 10-й день культивирования тельца извлекали из матрикса и помещали в отдельные лунки, где культивировали в среде StemPro-34 c добавлением факторов VEGF, SCF, Flt-3L, TPO и IL-3 (рис 1).
Рис 1. Схема эксперимента по получению из иПСК органоидов, имитирующих костномозговую кроветворную нишу человека (Frenz-Wiessner et al., 2004, https://doi.org/10.1038/s41592-024-02172-2)
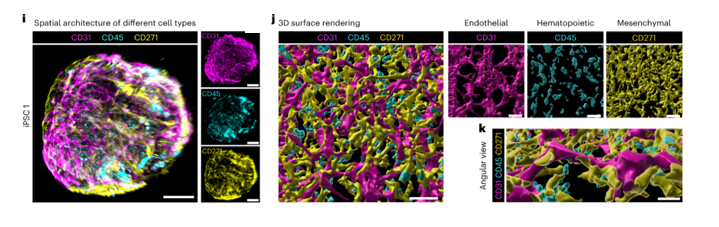
На 17-й день культивирования в полученных органоидах методами проточной цитометрии и иммунофлуоресценции с последующей 3d-визуализацией были выявлены три основных кластера -эндотелиальный (CD45-CD31+), гемопоэтический (CD45+) и мезенхимальный (CD45-CD31-CD271+) – рис 2. Соотношение клеток в среднем по нескольким опытам – 39,3% гемопоэтических (из них около 1,4% гемопоэтических стволовых и прогениторных клеток, ГСПК), 41,3% мезенхимальных (из них около 1% мезенхимальных стволовых и прогениторных клеток, МСПК) и 6% эндотелиальных клеток.
Рис 2. Поверхностная визуализация 3D z -реконструкции из конфокального изображения, отображающая CD45 + (гемопоэтические), CD31+ (эндотелиальные) и CD271 + (мезенхимальные) клетки (Frenz-Wiessner et al., 2004, https://doi.org/10.1038/s41592-024-02172-2)
Каждая популяция клеток была исследована морфологически и функционально. Интересно, что в данной системе, помимо сосудистой сети с гемопоэтическими клетками в просветах, МСПК, способствующих размножению и самообновлению ГСК, и перицитов, авторам удалось обнаружить функциональные продуцирующие CXCL12 ретикулярные клетки (CAR-клетки), которые играют важнейшую роль в нормальном кроветворении в костном мозге (Aoki et al, 2021). В целом, было показано, что пространственная архитектура органоидов повторяет основные особенности мезенхимальной и сосудистой ниши костного мозга человека.
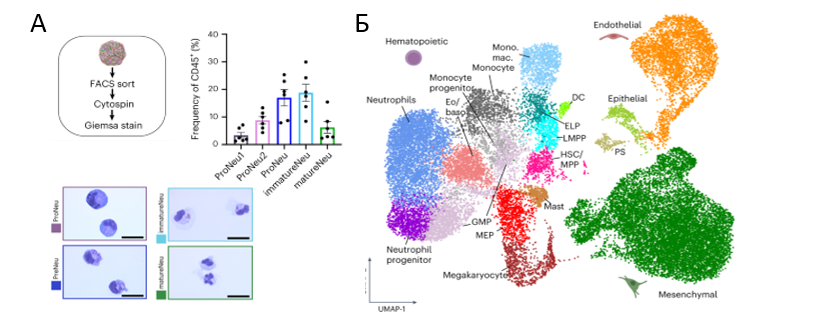
Важным моментом является получение в данной системе кроветворных клеток различных линий – различные миелоидные предшественники, моноциты, нейтрофилы, тучные клетки, дендритные клетки, мегакариоцитарные предшественники, и лимфоидные предшественники, что убедительно показано с помощью scRNA-seq (рис 3, Б). Дополнительно, с помощью проточной цитометрии, иммунофлуоресеценции и окрашивания ядер, на примере нейтрофилов показан гранулопоэз - обнаружены гранулоциты разной степени зрелости (рис 3, А). Наконец, авторы обнаружили в органоидах ГСПК, обладающие способностью к мультилинейной дифференцировке и экспрессирующие ключевые факторы транскрипции, связанные с дефинитивными ГСК и необходимые для самообновления (MLLT3), поддержания (MECOM) и сохранения в недифференцированном состоянии этих клеток (HLF). В статье показано, что внутри органоидов происходит эндотелиально-кроветворный переход, что хорошо согласуется с данными о нормальном гемопоэзе. Исходя из всех этих данных, авторы делают выводы об адекватности данной модели для изучения гемопоэза у человека in vitro.
Рис 3. Анализ кроветворных линий, полученных в органоидах. А - количественная оценка содержания субпопуляций предшественников нейтрофилов в популяции CD45 + и окрашивание по Май-Грюнвальду отсортированных предшественников нейтрофилов, полученных из органоидов, и зрелых нейтрофилоподобных клеток. Б – транскриптомный анализ на уровне одиночных клеток, полученных после диссоциации органоидов (алгоритм UMAP) (Frenz-Wiessner et al., 2004, https://doi.org/10.1038/s41592-024-02172-2).
Чтобы проверить насколько хорошо работает данная модель, авторы создали органоиды из иПСК с мутацией Thr224Asn в VPS45. Такая система моделирует дефицит белка VPS45, приводящий к тяжелой врожденной нейтропении и миелофиброзу. В данной модели достаточно четко отражались эффекты, наблюдаемые при сходной патологии у детей, - фиброз (повышенные отложения волокон ретикулина), увеличение экспрессии гладкомышечного актина, усиление апоптоза в популяции нейтрофилов.
Таким образом, создание органоидов из иПСК человека может стать хорошим инструментом для изучения развития кроветворения и моделирования заболеваний в сложной трехмерной среде, имитирующей кроветворную нишу костного мозга человека и демонстрирующей ее основные функциональные и структурные особенности.
Список литературы
- Chou, D. B. et al. On-chip recapitulation of clinical bone marrow toxicities and patient-specific pathophysiology. Nat. Biomed. Eng. 2020. 4, 394–406.
- Giger, S. et al. Microarrayed human bone marrow organoids for modeling blood stem cell dynamics. APL Bioeng. 2022. 6, 036101.
- Aoki, K et al. Identification of CXCL12-abundant reticular cells in human adult bone marrow. Br J Haematol. 2021. 193(3):659-668.
Новость подготовила
© Шевелева Ольга Николаевна
03.12.2024