L.Ma, B.R. Thapa, J.A. Le Suer, A. Tilston-Lunel, M.J. Herriges, A. Berical, M.L.Beermann, F. Wang, P.S. Bawa, A. Kohn, A.B. Ysasi, H. Kiyokawa, T. M. Matte, S.H. Randell, X. Varelas, F.J. Hawkins, D.N. Kotton «Airway stem cell reconstitution by the transplantation of primary or pluripotent stem cell-derived basal cells». Cell Stem Cell 30, 1199–1216, September 7, 2023
M.J. Herriges, M. Yampolskaya, B.R. Thapa, J. Lindstrom-Vautrin, F. Wang, J. Huang, C.-L. Na, L. Ma, M.M. Montminy, P. Bawa, C. Villacorta-Martin, P. Mehta, D.N. Kotton «Durable alveolar engraftment of PSC-derived lung epithelial cells into immunocompetent mice». Cell Stem Cell 30, 1217–1234, September 7, 2023
Повреждение эпителия в дистальных и проксимальных отделах легких, вызванное различными патологиями (COVID-19, фиброз, энфизема, муковисцедоз, первичная цилиарная дискенезия и другие) приводит к снижению респираторной функции и, как следствие, летальному исходу. Эффективность лечения с помощью пересадки непосредственно органа – легкого – существенно снижена за счет риска осложнений и отторжения донорской ткани, даже на фоне приема иммуноподавляющих препаратов. Кроме того, трансплантация органа ограничена количеством доноров легких. Перспективным методом решения проблемы представляется трансплантация клеток верхних или нижних дыхательных путей. Трансплантируемые клетки должны обеспечивать поддержание гомеостаза в эпителиальной ткани и обладать хорошей приживаемостью, пролиферативной активностью, способностью к самообновлению и дифференциации. Известны работы, в которых успешно продемонстрирована возможность трансплантация клеток легких in vivo, способных экспрессировать маркеры зрелого эпителия (1-3). Однако, клетки обладали коротким периодом жизнеспособности и утилизировались первичным эпителием легких или иммунной системой.
Для альвеолярного эпителия легких эндогенным прогенитором являются трудно культивируемые in vitro альвеолоциты 2 типа (АТ2 клетки). Также первичные эмбриональные tip-подобные клетки мыши (distal fetal bud tip) были трансплантированы успешно в альвеолы и могут быть использованы в качестве источника донорских клеток мыши. Однако, человеческие эмбриональные клетки легких являются трудно доступными, что делает слабо применимым использование данных клеток в терапии. В верхних дыхательных путях основной мишенью для клеточной терапии считаются хорошо описанные стволовые клетки респираторного эпителия – базальные клетки (БК). При этом, воздействие на БК затруднено люминальными клетками, примыкающими к поверхности верхних дыхательных путей, и иммунной системой, защищающей эпителий бронхов от экзогенных клеток, патогенов и частиц. Таким образом, получение клеток для успешной трансплантации, с последующей приживаемостью и функционированием, в альвеолярных или бронхиолярных участках легких остается актуальной задачей.
В качестве решения проблемы в работах D.N. Kotton с коллегами предложены методики получения альвеолярных эпителиальных прогениторов и БК из плюриопотентных стволовых клеток (ПСК).
Для получения ПСК-полученных альвеолярных эпителиальных прогениторов in vivo был разработан специальный протокол для прямой дифференциации эмбриональных стволовых клеток (ЭСК) мыши в tip-подобные эпителиальные клетки. ЭСК-полученные tip-подобные клетки схожи с первичными tip-подобными клетками и поддерживают их прогениторный профиль in vitro даже после многократного пассирования. Кроме того, полученные клетки сохраняют свою идентичность при заморозке. В работе ЭСК- полученные клетки были трансплантированы в иммунокомпетентного рецепиента, где сохраняли свою идентичность in vivo. Спустя 2 недели после трансплантации tip- подобные клетки донора дифференцировались в АТ2- и АТ1-подобные клетки альвеол. Показано, что полученные донорские клетки, созданные вне легких, могут дифференцироваться после трансплантации и сохранять жизнеспособность в течение длительного периода (6 месяцев) в присутствии функционирующей иммунной системы. С помощью транскриптомного анализа единичных клеток (scRNA-seq) показано, что ПСК- полученные клетки донора могут дифференцироваться in vivo в клетки эндогенного альвеолярного эпителия с достоверной экспрессией канонических маркеров, ассоциированных с этими клетками. Кроме того, в работе показано, что АТ2-подобные клетки-доноры продуцируют ламелларные тельца, являющиеся специализированными органеллами необходимыми для секреторной функции АТ2 клеток.
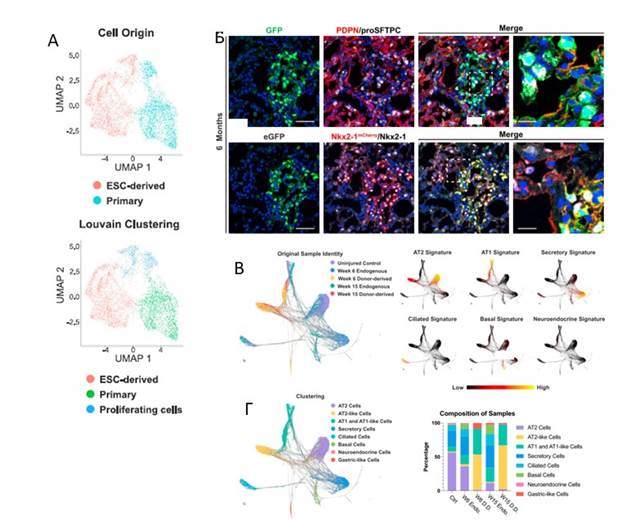
Рис. 1. ЭСК-полученные tip-подобные клетки являются морфологически и транскприционно схожими с первичными tip-подобными клетками. А. Показан UMAP график scRNA-seq анализа первичных и ЭСК- полученных tip-подобных клеток (вверху). Louvain clusters (внизу). Б. Гистологический анализ клеток-доноров через 6 месяцев после трансплантации. В. SPRING график эпителиальных клеток, охарактеризованных с помощью scRNA-seq анализа. Экспрессия генов эпителиальных клеток легких. Г. Кластеризация по клеточным типам на основе контролируемой кластеризации Louvain и экспрессия эпителиальных клеток легких. Гистограмма состава выборки по кластерам.
Для восстановления эпителиальных клеток верхних дыхательных путей были использованы первичные и ПСК-полученные базальные стволовые клетки. В работе разработан протокол получения специальной безсывороточной среды, которая может быть использована для культивирования первичных и ПСК-полученных базальных стволовых клеток в трансплантационных исследованиях. Трансплантация первичных БК и ПСК-полученных БК в сингеннных иммунокомпетентных мышей, после повреждения эпителия верхних дыхательных путей полидаканолом, выявила хорошую приживаемость клеток-доноров, отсутствие иммунносупрессии, а также замену более, чем 50% эндогенного трахеального эпителия клетками-донорами. Согласно транскриптомному анализу трансплантируемые первичные БК экспрессировали маркеры базальных, секреторных, реснисчатых клеток, а также ионоцитов, нейроэндокринных и tuft-клеток, что соответствует экспрессии эндогенных БК. ПСК-полученные БК экспрессировали основные гены эпителия верхних дыхательных путей, однако в терминах глобальных транскрипционных профилей отличались от их эндогенных аналогов. Так, ПСК- полученные базальные и секреторные линии демонстрировали различия в паттернах активности. Не смотря на транскрипционные различия, ПСК-полученные клетки нормально функционировали in vivo, в частности пролиферировали из БК после повреждения. При этом, человеческие первичные БК и ПСК-полученные БК проявляли высокий уровень транскрипционной схожести in vivo после трансплантации.
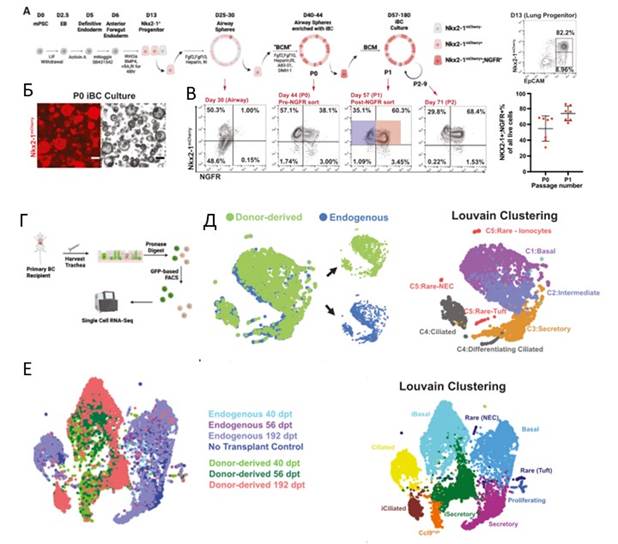
Рис. 2. А. Схематическая in vitro дифференциация ПСК клеток, несущих Nkx2-1 mCherry в базальные эпиталиально-подобные клетки, с их последующим культивированием в монослойных эпителиальных сферах в безсывороточной 3D среде. Флуоресцентный активируемый сортинг (ФАКС) на 13 день. Б. Репрезентативная ПСК-полученная культура БК (52 д), пассаж 1. В. ФАКС на различных этапах дифференцировки ПСК- полученных БК. Г. Схема получения клеток и scRNA-seq анализа для эндогенных БК и клеток-доноров первичных БК. Д. SPRING визуализация транскриптомных профилей первичных БК. Кластеризация Louvain. Е. SPRING визуализация транскриптомных профилей ПСК-полученных БК. Кластеризация Louvain.
Таким образом, клетки, дифференцируемые из ПСК, демонстрируют хорошую приживаемость, не подавляются иммунной системой и обеспечивают нормальной функционирование эпителия в течение длительного времени как проксимальных, так и в дистальных отделах легких, что делает их перспективным объектом для изучения в контексте трансплантационной терапии.
Список использованной литературы:
- Vaughan, A.E., Brumwell, A.N., Xi, Y., Gotts, J.E., Brownfield, D.G., Treutlein, B., Tan, K., Tan, V., Liu, F.C., Looney, M.R., et al. (2015). Lineage-negative progenitors mobilize to regenerate lung epithelium after major injury. Nature 517, 621–625. DOI: 10.1038/nature14112
- Ma, L., Thapa, B.R., Le-Suer, J., Tilson-L€unel, A., Herriges, M.J., Berical, A., Beerman, M.L., Wang, F., Bawa, P.S., Randell, S.H., et al. (2023). Airway stem cell reconstitution by transplantation of cultured primary or PSC-derived basal cells. Cell Stem Cell 30, 1199–1216. DOI: 10.1016/j.stem.2023.07.01
- Miller, A.J., Hill, D.R., Nagy, M.S., Aoki, Y., Dye, B.R., Chin, A.M., Huang, S., Zhu, F., White, E.S., Lama, V., et al. (2018). In vitro induction and in vivo engraftment of lung bud tip progenitor cells derived from human pluripotent stem cells. Stem Cell Rep. 10, 101–119. DOI: 10.1016/j.stemcr.2017.11.012
Новость подготовила
© И.А.Говорова
02.10.2023