Комментарий к статье: Xu, PF., Borges, R.M., Fillatre, J. et al. Construction of a mammalian embryo model from stem cells organized by a morphogen signalling centre. Nat Commun 12, 3277 (2021). https://doi.org/10.1038/s41467-021-23653-4
 © Александра Ветрова, аспирантка лаборатории эволюции морфогенезов. Область научных интересов: биология развития беспозвоночных, EvoDevo, роль сигнальных путей в развитии.
© Александра Ветрова, аспирантка лаборатории эволюции морфогенезов. Область научных интересов: биология развития беспозвоночных, EvoDevo, роль сигнальных путей в развитии.
Разработан новый подход к культивированию агрегатов эмбриональных стволовых клеток, позволяющий получать in vitro эмбрион мыши, у которого формируется бьющееся сердце, сосуды, нервная трубка и первичная кишка (Xu et al., 2021). Это значительный прорыв в многолетних попытках получать in vitro эмбрионы, развитие которых воспроизводит развитие эмбрионов in vivo. Новый метод позволит исследователям лучше понять, как происходит эмбриональное развитие млекопитающих. В перспективе, этот метод может быть использован для фармакологических исследований и разработки методик по выращиванию из стволовых клеток тканей и органов, подходящих для трансплантации.
Уже несколько лет существуют методики, позволяющие получать из эмбриональных стволовых клеток (ЭСК) мыши т.н. "эмбриоиды" - структуры, напоминающие эмбрионы. Их называют бластоиды, гаструлоиды и туловище-подобные структуры (trunk-like structures). Для получения таких структур разработаны два основных подхода. Первый подход - формирование агрегатов из эмбриональных и экстра-эмбриональных стволовых клеток. Такой агрегат развивается за счёт процессов самоорганизации до стадии, соответствующей середине гаструляции. В полученных с помощью этого подхода эмбриоидах не представлен полный спектр структур, клеток и тканей нормального эмбриона мыши. При использовании второго подхода агрегаты могут развиться до стадии нейрулы. В этом случае агрегаты подвергают кратковременному воздействию агониста сигнального пути Wnt и антагониста сигнального пути BMP (эти вещества добавляют в среду культивирования). В агрегатах образуется центр экспрессии Brachyury, соответствующий заднему полюсу, формируются поляризованные в ан терио-постериорном направлении сомиты и нервная трубка, но отсутствует правильная организация тканей и не формируется голова.
Исследователи из лаборатории под руководством Бернарда Тиссе (Dr. Bernard Thisse) и Кристин Тиссе (Dr. Christine Thisse) (Университет Вирджинии) предположили, что неспособность агрегатов к формированию головы связана с условиями культивирования. Добавленные прямо в среду сигнальные молекулы действуют сразу на все клетки агрегата, которые приобретают свойства, характерные для клеток заднего региона. Чтобы этого избежать, в агрегате эмбриональных стволовых клеток нужно сформировать пространственно локализованный сигнальный центр. Авторы статьи использовали два агрегата из эмбриональных стволовых клеток (Рис. 1а, b). В агрегате, состоящем из 50 клеток, с помощью BMP4 индуцировали экспрессию Wnt3 и Nodal, а затем поместили его на агрегат из 100 наивных клеток. Два агрегата слились в один, и клетки маленького агрегата (обработанного BMP4) сформировали сигнальный центр, локализованный на одном из полюсов развивающегося эмбриоида (Рис. 1а-е). Wnt3 и Nodal индуцировали экспрессию гена Brachyury (Bra), маркера мезодермы и первичной бороздки.
Важно, что экспрессия Bra (и других генов-маркеров, таких как Eomes, Otx2) наблюдалась не только в клетках маленького агрегата (сигнального центра) (Рис. 1f), но и в клетках большого агрегата. Таким образом, маленький агрегат выполнял роль осевого организатора, индуцируя формирование молекулярной разметки передне-задней и дорзо-вентральной осей эмбриоида.
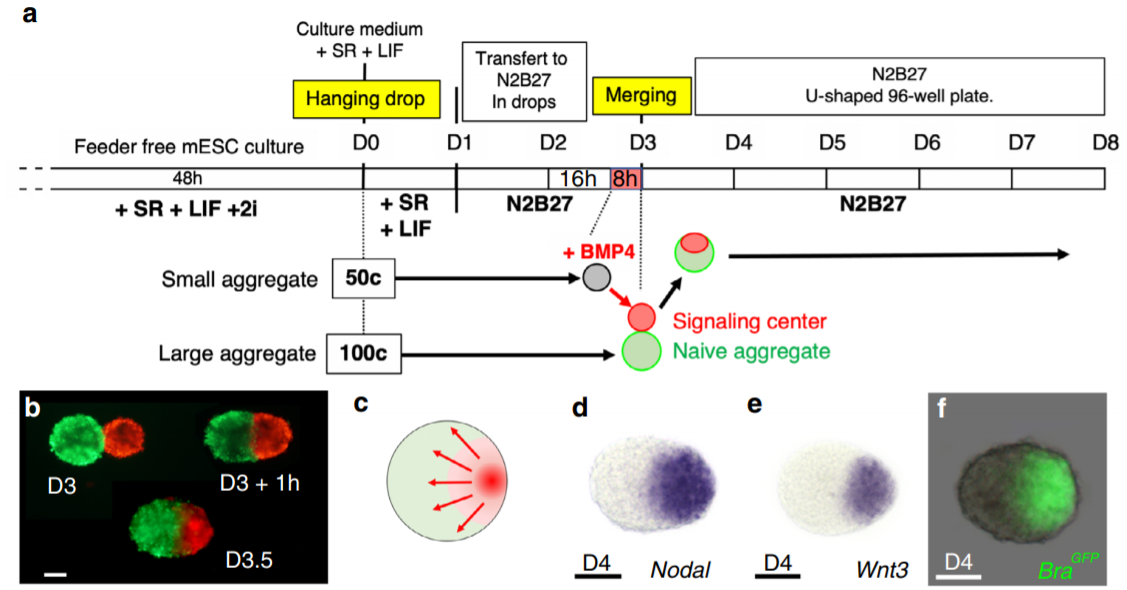
В полученном эмбриоиде происходило разделение трёх зародышевых листков, причём гаструляционные морфогенезы (формирование первичной бороздки) и миграционное поведение клеток в точности воспроизводили процессы гаструляции in vivo. Как и у эмбриона мыши, у эмбриоида во время гаструляции имелись отдельные популяции эндодермальных и мезодермальных клеток.
Из производных мезодермы у эмбриоида формируются хорда, сегментированная параксиальная мезодерма, промежуточная мезодерма и мезодерма боковой пластинки. В переднем регионе боковой пластинки образуется сердечная мышечная ткань, которая на 7.5 день культивирования начинает сокращаться. У эмбриоида начинается образование сосудов и клеток крови, причём оба процесса правильно ориентированы относительно всех трёх осей тела.
Под хордой у эмбриоида формируется кишка, эпителий которой сформирован как висцеральной, так и дефинитивной эндодермой. Эпителий кишки размечен в антерио-постериорном направлении, можно различить участки, экспрессирующие маркёры передней, средней и задней кишки. Эндодерма также формирует структуры, напоминающие желточный мешок и желточный стебелёк.
Над хордой формируется нервная пластинка. Судя по экспрессии генов-маркёров, нервная пластинка эмбриоида корректно размечена вдоль антерио-постериорной и дорсо-вентральной осей. Она соответствует нервной пластинке эмбриона, и в ней представлены все регионы от каудального отдела до заднего отдела среднего мозга. Однако самый передний регион нервной пластинки у эмбриоида отсутствует. У 15% эмбриоидов нервная пластинка замыкается в нервную трубку. Она также молекулярно размечена вдоль антерио-постериорной и дорсо-вентральной осей, а её организация на гистологическом уровне соответствует нервной трубке мышиного эмбриона.
В целом, авторы показали, что предложенная ими методика позволяет точно смоделировать развитие мыши in vitro. Стадии развития эмбриоида очень сходны со стадиями нормального эмбрионального развития мыши. Клетки, происходящие из разных зародышевых листков, успешно взаимодействуют, формируя правильно организованные ткани и органы. Пользуясь этим подходом, экспериментаторы могут: (а) выбирать время, начиная с которого сигнальный центр действует на наивные клетки, (б) изменять размер сигнального центра и (в) регулировать интенсивность воздействия. Кроме того, с помощью этого метода можно получать мозаичные эмбриоиды, в которых наивные и стимулированные клетки происходят из разных линий.
Новость подготовила © Ветрова А.
03.09.2021