к.б.н. доцент кафедры эмбриологии
МГУ им. М.В. Ломоносова,
с.н.с. лаборатории проблем
регенерации (группа эмбриофизиологии) ИБР РАН.
Область научных интересов: раннее эмбриональное развитие, оогенез, нейробиология развития.
Мутации de novo (DNM) – генетические изменения, возникающие впервые у индивида и отсутствующие у его родителей, – играют ключевую роль в эволюции и являются одной из основных причин спорадических наследственных заболеваний, включая многие нарушения развития. Понимание точной частоты и спектра DNM имеет фундаментальное значение для биологии развития, генетики человека и медицинской генетики.
Однако точная оценка частоты DNM у человека сопряжена со значительными методологическими трудностями. К ним относятся необходимость высокоточного секвенирования для различения истинных DNM от ошибок чтения или редких наследуемых вариантов, сложность в определении родительского происхождения мутации и потенциальное влияние соматического мозаицизма у родителей. Традиционные подходы, основанные на анализе трио (родители и ребенок), хотя и информативны, имеют ограничения в точности фазирования гаплотипов и разрешении сложных случаев. Недавнее исследование, опубликованное в журнале Nature группой ученых из Вашингтонского университета под руководством Эвана Э. Эйхлера, представляет новаторский подход к этой проблеме, основанный на анализе родословной в четырех поколениях. Авторы использовали комбинацию современных технологий секвенирования и биоинформатического анализа, чтобы с высокой точностью картировать DNM в геномах 28 членов семьи CEPH 1463. Этот подход позволил авторам с высокой точностью отслеживать передачу генетических вариантов и, что наиболее важно, идентифицировать истинные мутации de novo. В отличие от стандартного трио-анализа, многопоколенный анализ позволяет реконструировать протяженные гаплотипы и более надежно отличать DNM от унаследованных вариантов, особенно редких.
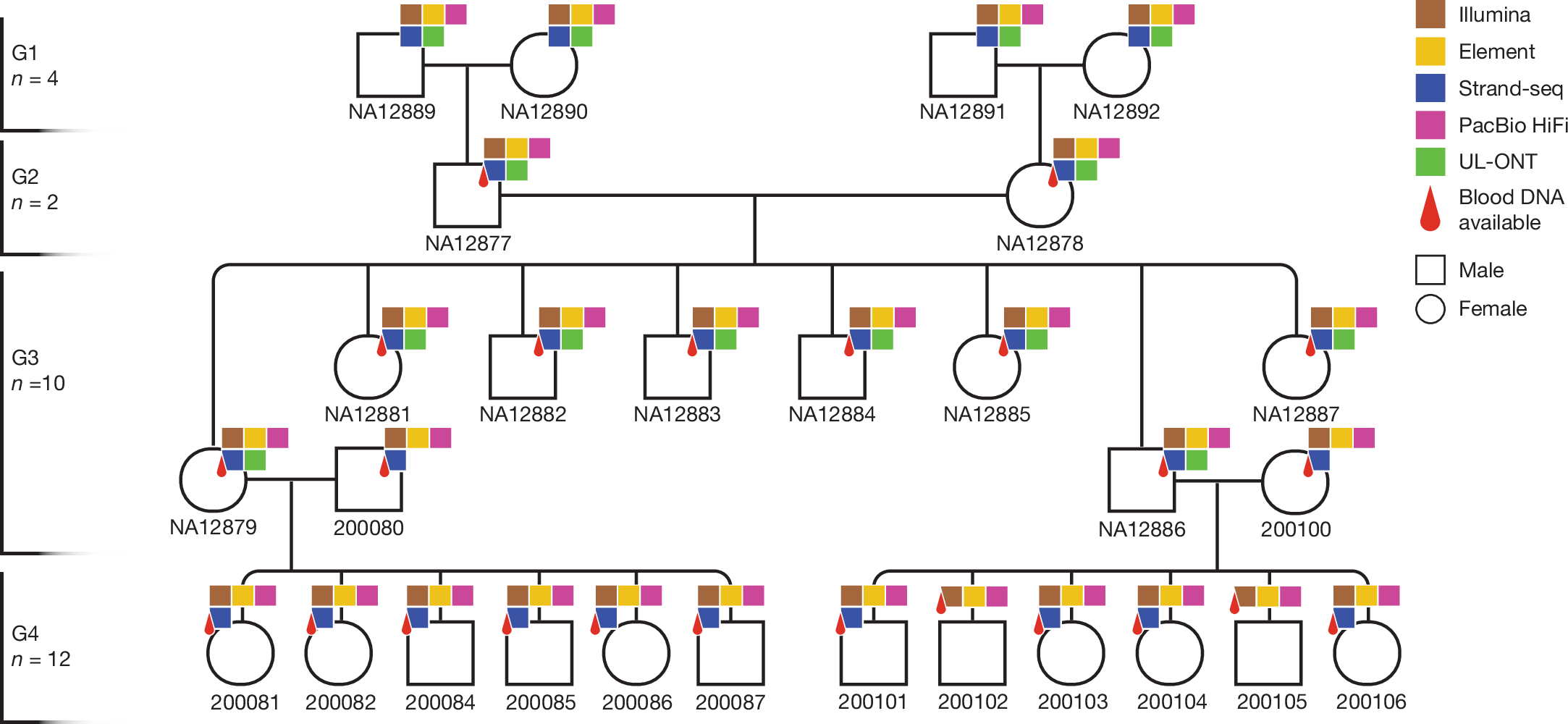
Авторы применили комплексный подход, включающий высокопроизводительное полногеномное секвенирование (WGS) с высоким покрытием для всех доступных членов родословной. Были использованы пять комплементарных технологий секвенирования (Рис. 1), различающихся по длине прочтений и типу ошибок: PacBio HiFi, Oxford Nanopore Technologies (UL-ONT), Strand-seq, Illumina и Element AVITI Biosciences. Особое внимание было уделено разработке и валидации усовершенствованных биоинформатических алгоритмов для выявления различных типов мутаций – от однонуклеотидных замен (SNV) и небольших инсерций/делеций (инделов) до более крупных структурных вариантов (SV). Решение технических проблем включало разработку методов для фильтрации артефактов секвенирования и точного определения родительского происхождения DNM. Использование данных от прародителей позволило значительно повысить достоверность идентификации DNM у потомков, минимизируя ложноположительные результаты, которые могут возникать из-за неполного охвата генома или ошибок при секвенировании родительских образцов в исследованиях трио. Важным техническим достижением авторов стало получение высококачественных сборок геномов, охватывающих более 95% каждого диплоидного генома, включая центромеры и другие сложные повторяющиеся области.
Рис. 1. Родословная четырех поколений семьи CEPH 1463. Геномы двадцати восьми членов семьи были секвенированы с использованием пяти ортогональных платформ секвенирования нового поколения и LRS: HiFi-секвенирование, секвенирование Illumina и Element было проведено на периферической крови для G2–G4, а данные UL-ONT и Strand-seq были получены на доступных лимфобластоидных клеточных линиях для G1–G3.
Исследование предоставило наиболее точные на сегодняшний день оценки частоты возникновения мутаций de novo у человека. Авторы оценили частоту DNM в диапазоне 98–206 на передачу, включая 74,5 однонуклеотидных вариантов, 7,4 инделов вне тандемных повторов, 65,3 инделов/структурных вариантов в тандемных повторах и 4,4 DNM в центромерных областях. У мужчин было обнаружено 12,4 DNM в Y-хромосоме на поколение. Короткие тандемные повторы (STR) и тандемные повторы с переменным числом копий (VNTR) оказались наиболее мутабельными участками генома, причем в 32 локусах наблюдались рекуррентные мутации в разных поколениях. Обнаружен выраженный отцовский эффект для всех типов герминальных DNM (75–81%). Около 16% SNV de novo оказались постзиготическими по происхождению и не имели отцовского смещения. При этом корреляции между мейотическим кроссинговером и возникновением DNM выявлено не было.
Полученные результаты имеют огромное значение для понимания фундаментальных механизмов мутагенеза у человека. Уточненные данные о частоте DNM позволяют более точно моделировать эволюционные процессы и оценивать генетический груз популяций. Авторы подчеркивают, что использование многопоколенной родословной обеспечивает "золотой стандарт" для идентификации DNM, превосходящий по точности анализ трио. Это позволяет не только получить более надежные оценки общей частоты мутаций, но и более детально изучить их спектр и контекст возникновения.
Авторы убедительно показали, что мутагенез не является случайным процессом, а зависит от структуры ДНК и родительского происхождения. Высокая мутабельность тандемных повторов может быть связана с особенностями репликации и репарации ДНК в этих областях. Отцовский эффект, вероятно, обусловлен большим числом делений клеток сперматогенеза по сравнению с оогенезом. Обнаружение постзиготических мутаций указывает на вклад ошибок репликации ДНК на ранних стадиях эмбриогенеза в генетическую изменчивость человека.
Результаты нового исследования согласуются с данными, полученными другими научными группами, о высокой мутабельности тандемных повторов и отцовском эффекте в мутагенезе человека. В частности, авторы подтвердили ранее известные факты о том, что отцовский возраст влияет на количество мутаций de novo. В то же время, был сделан ряд новых открытий, в том числе обнаружение большого количества мутаций в Y-хромосоме, выявление рекуррентных мутаций в определенных локусах генома, обнаружение мутаций в центромерных областях хромосом и определение доли постзиготических мутаций.
Результаты исследования открывают новые направления для дальнейших исследований мутагенеза человека. В контексте биологии развития, будущие исследования могут быть направлены на изучение связи между временем возникновения DNM и их фенотипическими проявлениями. Также перспективно использование этих данных для более точного расчета риска повторения заболеваний, вызванных DNM, в семьях. Разработка улучшенных моделей для предсказания вероятности возникновения DNM у конкретного индивида на основе возраста родителей и других факторов станет важным шагом для персонализированной медицины и генетического консультирования.
Исследование Порубски и коллег представляет собой значительный шаг вперед в нашем понимании фундаментальных процессов мутагенеза у человека. Предоставляя эталонные данные о частоте и спектре мутаций de novo, полученные с использованием методологически продвинутого подхода, эта работа окажет существенное влияние на будущие исследования в области генетики человека, эволюционной биологии и, безусловно, биологии развития. Уточненные параметры мутационного процесса критически важны для оценки роли DNM в этиологии нарушений развития и для разработки более точных методов генетического консультирования. Эта работа не только отвечает на существующие вопросы, но и ставит новые, стимулируя дальнейшие изыскания в этой динамично развивающейся области.
Новость подготовил
© Никишин Денис Александрович, к.б.н., , к.б.н. доцент кафедры эмбриологии МГУ им. М.В. Ломоносова,
с.н.с. лаборатории проблем регенерации (группа эмбриофизиологии) ИБР РАН.
02.06.2025