 © Куликова Дина Александровна, с.н.с., к.б.н. лаборатории МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ПРОЦЕССОВ РАЗВИТИЯ.
© Куликова Дина Александровна, с.н.с., к.б.н. лаборатории МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ПРОЦЕССОВ РАЗВИТИЯ.
Что такое «парамутация»? Этот феномен определяют, как неменделевское взаимодействие двух аллелей одного гена, при котором один из аллелей («парамутагенный») вызывает наследуемые изменения функциональности другого аллеля («парамутабильного»), не меняя первичной последовательности ДНК. Почти все классические примеры этого феномена были открыты у растений. Единичные случаи парамутации у животных малоизучены. Известно, что механизм парамутации обычно зависит от наличия малых некодирующих РНК, которые могут «замалчивать» альтернативный аллель в транс-положении, либо путём привлечения белков машины РНК-интерференции непосредственно к траскриптам гена и их разрушения, либо изменением статуса активности хроматина в районе локализации гена.
В статье описывается система эпигенетического изменения свойств одного аллеля гена center divider (cdi), обозначенного cdiI, под воздействием другого аллеля – cdiA - у Drosophila virilis. Этот ген расположен в теломерном районе, где расположены большие массивы ретротранспозонов, которые регулируются с помощью малых некодирующих РНК, ассоциированных с белками типа Argonaute подсемейства PIWI (пиРНК). пиРНК образуются из длинных одноцепочечных предшественников, которые кодируются различными участками генома – кластерами пиРНК. В этих кластерах находятся поврежденные копии мобильных элементов. пиРНК-кластеры, работающие в герминативных тканях дрозофилы, являются двунитевыми, потому что с них происходит транскрипция, как в смысловом, так и в антисмысловом направлениях. пиРНК участвуют в регуляции активности транспозонов как на транскрипционном, так и на пост-транскрипционном уровне. Экспрессия теломерных ретротранспозонов в герминативных тканях дрозофилы тоже находится под контролем пиРНК системы. Главное отличие теломерных кластеров пиРНК от других пиРНК-кластеров заключается в том, что их транкрипты являются, как источником пиРНК, так и их мишенью. Теломерные транскрипты процессируются, образуя пиРНК, которые регулируют экспрессию теломерных мобильных элементов. При нарушении этого пути происходит разрушение теломерного гетерохроматина и накопление РНК теломерных ретротранспозонов, что приводит к структурным изменениям теломеры. В исследовании М. Евгеньева с коллегами в 2010 было показано, что одна из линий D. virilis (160) несет несколько субтеломерных кластеров пиРНК, в которых расположены белок-кодирующие гены, и были обнаружена пиРНК к транскриптам этих генов, а не только к транскриптам транспозонов. Ген cdi в этой линии располагается в одном из таких кластеров на второй хромосоме, поэтому его экспрессия в зародышевых клетках была подавлена, хотя в норме он экспрессируется в репродуктивных клетках самок.
При скрещивании самок этой линии с самцами другой линии (9), где ген cdi не выключен, приводит к образованию активного кластера на интактном гомологе в потомстве, а экспрессия гена практически отсутствует (рис.1).
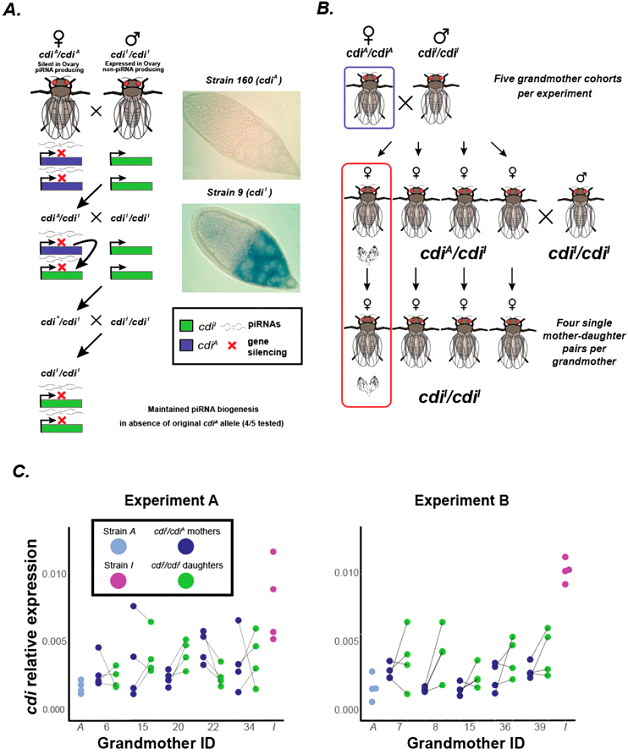
(А) Схема преобразования активного аллеля cdiI линии 9, в неактивный, несущий новый двунетевой пиРНКовый кластер, при взаимодействии с пиРНКовым кластером аллеля cdiA линии 160. Эксперименты in situ показывают экспрессию гена cdi в яйцевой камере самок из линии 9 и ее отсутствие в яйцевой камере самок линии 160, это доказывает, что материнское наследование пиРНК к данному локусу является необходимым условием образования нового пиРНКового кластера. (В) Схема, проведенных скрещиваний. (С) Низкая экспрессия гена cdi сохраняется даже в отсутствии исходного кластера пиРНК.
Исследование показало, что именно наследуемые материнские пиРНК из линии с активным пи-РНКовым кластером имеют решающее значение и запускают продукцию пиРНК с отцовского аллеля, преобразуя его в новый пиРНКовый кластер, хотя и более слабый. Тем не менее, биогенез пиРНК может после первичной активации поддерживаться в последующих поколениях в отсутствии исходного аллеля cdiA. В реципрокном скрещивании, когда аллель cdiA приходил от отца обнаруживалась лишь слабая продукция пиРНК к гену cdi в зародышевой линии, и снижения экспрессии гена не наблюдалось. Это отличает найденный механизм парамутации животных от такого же механизма в растениях, где способность запускать эпигенетичские преобразования альтернативного аллеля не зависит от родительского происхождения парамутагенного аллеля.
Известно, что многие виды рода Drosophila используют ретротранспозоны для поддержания теломерного участка хромосомы, а механизм пиРНК опосредованного сайленсинга регулирует эти теломерные ретротранспозоны, поэтому авторы решили изучить существуют ли структурные отличия в теломерах, которые бы объясняли разницу между двумя типами аллелей. Для этого они использовали уже существующие в базах данных сборки, а также собственные данные, полученные с помощью секвенирования методом нанопор.
Оказалось, что в линии 160 конец теломеры расположен ближе к аллелю cdiA, чем к аллелю cdiI линии 9, и в нем находится меньше сателлитных последовательностей между геном cdi и белковым комплексом на конце теломеры. Был обнаружен еще один интересный факт: ген cdi в обоих аллелях фланкирован фрагментом мобильного элемента TART. Скорее всего, это играет важную роль в подавлении экспрессии гена cdi с помощью первоначального нацеливания пиРНК на район гена и создание нового пиРНКового кластера, который захватывает сам ген в линии 160. В линии 9, как показали авторы, количество пиРНК, комплементарных к этому району, снижено, именно поэтому, вероятно, пиРНКвый кластер в ней не образуется. Несмотря на подробное изучение строения теломеры в обеих линиях к четкому пониманию механизма парамутации авторы не пришли.
Авторы в своей статье впервые показывают наличие естественного механизма парамутации у Drosophila. До сих пор возможность существования этого феномена у Drosophila было показано только на искусственных системах, созданных с помощью трансгенных конструкций. Было показано, что у животных, в отличие от растений механизм запуска эпигенетического преобразования аллеля критично зависит от материнского наследования пиРНК. Открытие естественного механизма дает возможность изучить, какой вклад в эволюционный процесс могут вносить изменения признаков, не связанные с обычным изменение генетического материала. Кроме того, авторы подробно изучили структуру теломерного участка хромосомы, где находится ген, подвергнутый парамутации. Это дает возможность подобраться как к еще неизвестным механизмам формирования новых двунетевых пиРНКовых кластеров, так и к еще менее изученному механизму феномена парамутации.
Новость подготовила
© Куликова Дина Александровна
02.05.2023