Комментарий к статьям:
Tarazi S. et al. Post-gastrulation synthetic embryos generated ex utero from mouse naive ESCs // Cell. 2022. Vol. 185, № 18. P. 3290-3306.e25.
Amadei G. et al. Synthetic embryos complete gastrulation to neurulation and organogenesis // Nature. Nature Publishing Group, 2022. P. 1–3.
 © Евгения Ерофеева,
© Евгения Ерофеева, магистр I курса Биологического факультета МГУ, студентка лаборатории клеточной биологии ИБР РАН.
Целостный организм можно получить из тотипотентной зиготы. Зигота развивается в бластоцисту, которая состоит из трофобласта и внутренней клеточной массы. Трофобласт формирует внешний слой эмбриона, участвует в имплантации зародыша в стенку матки и образовании плаценты. Из внутренней клеточной массы развивается эпибласт, который дает начало трем зародышевым листкам [1]. Однако целый организм может развиться не только из тотипотентной зиготы, но и из агрегата плюрипотентных стволовых клеток (ПСК). ПСК при помещении их в определенные условия дифференцируются и самоорганизуются в структуру, имитирующую развитие эмбриона.
Две группы ученых в течение 8.5 дней выращивали искусственные эмбрионы из ПСК мыши – дольше, чем когда-либо. У этих эмбрионов развились отчетливо выраженные органы – бьющееся сердце, кишечная трубка, нейральные складки. Обе группы исследователей использовали схожие методы при получении искусственных эмбрионов – комбинировали три типа клеток (эмбриональные стволовые клетки, клетки трофобласта и клетки первичной энтодермы).
Исследователи группы Tarazi S. для получения эмбриона использовали наивные эмбриональные стволовые клетки (ЭСК) [2]. В наивных ЭСК под промотером DOX индуцировали экспрессию Cdx2 (маркер трофобластных стволовых клеток) или Gata4 (маркер первичной энтодермы), тем самым получая линии ТСК и первичной энтодермы (Рис.1).
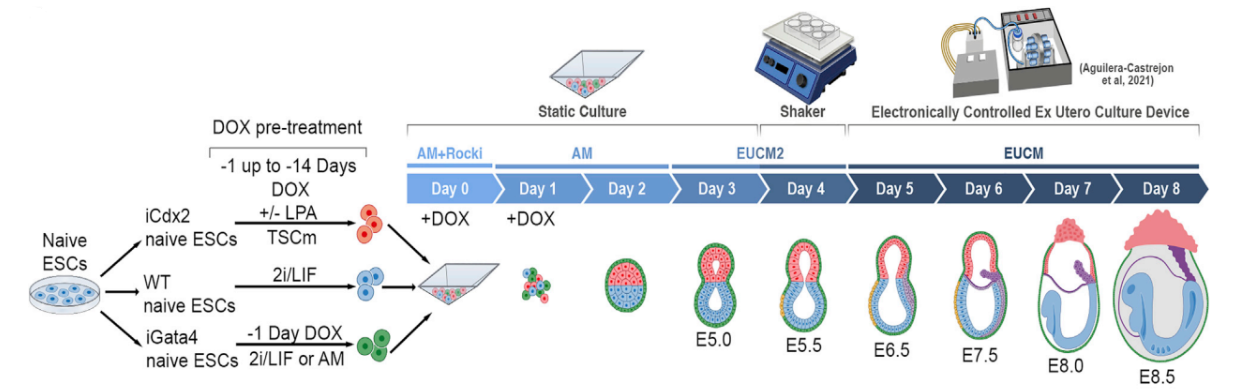
Ученые сгенерировали DOX-индуцибельные Cdx2 ЭСК, которые гиперэкспрессировали Cdx2 (далее линия называется iCdx2). Наивные iCdx2 дифференцировали в среде для стволовых клеток трофобласта (СКТ) в течение 7 дней. Также исследователи модифицировали среду, где проходила дифференцировка в трофобласт, путем ингибирования Hippo-сигналинга через взаимодействие лизофосфатидной кислоты с рецептором, связанным с G-белком, при этом эффективность дифференцировки iCdx2-клеток в клетки трофобласта значительно повышалась (до 75% популяции приобретало свойства стволовых клеток трофобласта). При отработке протокола оказалось, что ЭСК, культивируемые в условиях 2i/Lif, более эффективно дифференцировались в СКТ. Для создания первичной энтодермы ученые получали ЭСК, которые гиперэкспрессировали Gata4 под DOX индуцибельным промотером (далее линия ЭСК называется iGata4). На основе 2i/Lif среды спустя 24 часа после активации Gata4 в клетках можно было обнаружить маркеры первичной энтодермы.
Таким образом, направленная дифференцировка наивных ЭСК привела к формированию трех клеточных линий преимплантационного развития эмбриона мыши. Оптимальными условиями были: пре-индукция iGata4 в течение 24 часов в среде 2i/Lif или AM (среда для агрегации, в состав которой входил 20% FBS), пре-индукция Cdx2-клеток от 1 до 14 дней в среде СКТ (FGF4) путем ингибирования Hippo-сигналинга и поддержание ЭСК в наивном статусе.
Чтобы оценить самоорганизацию клеточных пластов и трекинг клеток в агрегатах, каждую из клеточных линий трансдуцировали лентивирусом, который экспрессировал флуоресцентный белок, и индуцировали с помощью DOX. (Рис.2)
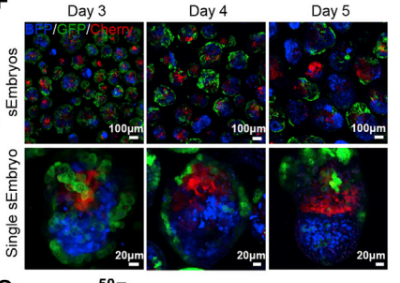
Далее в первые два дня агрегации трех клеточных линий в среду для агрегации (AM) добавляли DOX, что приводило к экспрессии Cdx2, Gata4 и репортерных белков в статичной культуре. На третий день среду AM заменили на культуральную среду с 30% сывороткой в условиях статичной культуры. На 4-й день из статических условий их переместили в шейкер, а на 5-й день – в роллерную культуральную систему в питательную среду с 75% сывороткой. С 5-го по 8-й день эмбрионы растили в данной роллерной системе. Ранее исследования показали, что при использовании заменителя сыворотки (KSR) на 4-7 сутки культивирования в статичных условиях развивались только желточные мешки.
Синтетические эмбрионы во время развития ex utero проходили гаструляцию и достигали стадии раннего органогенеза. Морфологические изменения синтетических эмбрионов во время развития похожи на изменения во время естественного эмбрионального развития мыши. На 4-й день развития у синтетических эмбрионов отчетливо выражены эпибласт и внезародышевая эктодерма, которые окружены слоем клеток висцеральной энтодермы. На 5-й день появляется проамниотическая полость, устанавливается асимметрия, зарождается первичная полоска. После 6-го дня появляются нервная пластинка, амниотическая полость, аллантоис. На 7-й день желточный мешок увеличивается и окружает эмбрион, выражена антеро-постериальная ось, обособляется область сердца. На 8-й день эмбрионы продолжают расти внутри желточного мешка и амниона и сходны с эмбрионами стадии Е8.5 – выражена дорсовентральная ось, в сосудах желточного мешка начинает циркулировать кровь, развивается бьющееся сердце, до четырех пар сомитов, хвост. Только 2% выращенных эмбрионов на этой стадии напоминают эмбрионы мыши на стадии E8.5.
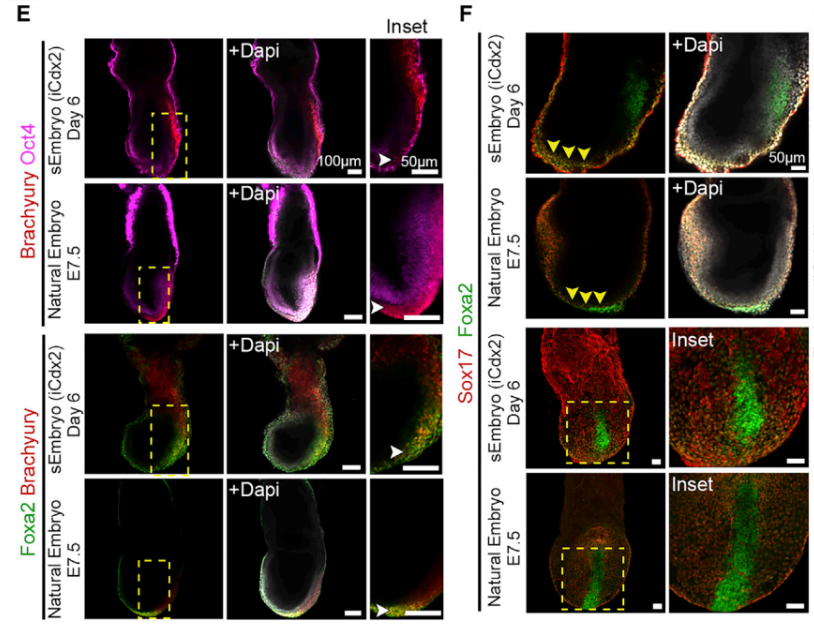
Паттерны экспрессии маркеров клеточных линий естественных и синтетических эмбрионов также были похожи. На ранней стадии развития мыши клетки эпибласта экспрессировали Oct4, Otx2, клетки внезародышевой эктодермы – Cdx2, Eomes, клетки висцеральной энтодермы – Gata4, Gata6, Sox17. Появление популяции клеток Брахиури (Brachyury) на 5-й день подтвердило формирование первичной полоски (Рис.3). Появляется осевая мезодерма (Foxa2/Brachyury+ клетки). На 8-й день клетки нервной складки и нервной трубки, находившиеся в области антеро-постериальной оси, экспрессировали Sox2. В передней части нервной складки была выявлена экспрессия Otx2, который является маркером переднего и среднего мозга эмбриона. Pax6 экспрессировался в переднем, заднем мозге, нервной трубке.
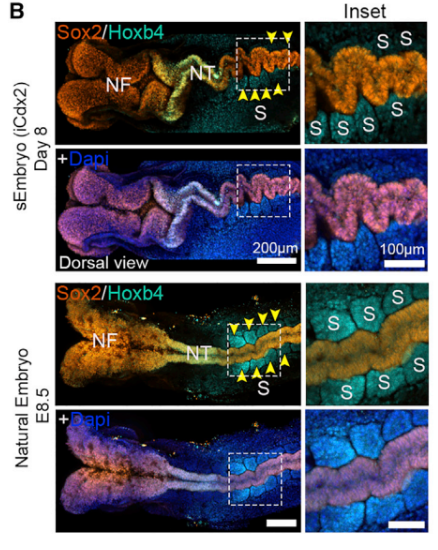
Экспрессия Hoxb4 свидетельствовала о формировании сомитов, примыкающих к нервной трубке (Рис.4). Паттерны экспрессии Sox17 клетками энтодермы и желточного мешка и Sox9 клетками нервного гребня также правильно распределялись. На 8-й день у эмбрионов формировались камеры сердца, развивались миокарда и эндокард. Кластерный анализ экспрессии генов показал, что транскрипционный профиль клеток синтетического эмбриона на 8-й день очень похож на профиль экспрессии клеток естественных эмбрионов.
Полученные результаты говорят о том, что выращенные ex utero эмбрионы во многом схожи с эмбрионами in utero. При этом в развитии большой части ex utero эмбрионов были выявлены отклонения и аномалии (у многих эмбрионов на 8-й день наблюдались увеличенное сердце, отсутствие определенных частей тела, развитие вне желточного мешка). Также одним из ограничений исследования являлось то, что при длительном пассировании линии СКТ наблюдается снижение количества Elf5+ клеток. Однако совершенствование условий культивирования клеток, протокола для агрегации, платформ для роста эмбрионов позволит получать эмбрионов с меньшим количеством отклонений, успешно проходящих гаструляцию, нейруляцию и органогенез.
Zernicka-Goetz с коллегами выделили клеточные линии из эмбриона мыши – эмбриональные стволовые клетки (ЭСК), стволовые клетки трофобласта (СКТ), клетки внезародышевой энтодермы [3]. Эти клеточные линии агрегировали и формировали эмбриоиды в статичной системе до 8 суток культивирования. Среду для дифференцировки и развития применили схожую со средой в работе Тарази и его коллег [2]. На 7-й день в среду добавили глюкозу. На 8-й день эмбрионов переместили в роллер.
Эмбриоиды, полученные таким способом, повторяли развитие in utero вплоть до 8.5 дня. У полученной модели обнаружили передний и средний мозг, нервную трубку, бьющееся сердце, сомиты, первичные половые клетки. Синтетическая модель развивалась во внезародышевом желточном мешке. На 5-й день у эмбриоидов развилась проамниотическая полость, был прослежен эпителиально-мезенхимальный переход. Синтетические эмбрионы на стадии гаструляции было очень похожи на естественных эмбрионов. На 7-й день у эмбрионов появилась антеро-постериальная ось, нервная трубка, хвост.
Исследователи создали эмбриоиды из Pax6 нокаутных ЭСК, в которых наблюдались отклонения в закладке нервной трубки, мозга и глаза. Это привело к расширению вентральной части нервной трубки эмбриона, что характерно и для естественных зародышей с нокаутом данного гена. Оценили экспрессию маркеров нейромезодермальных предшественников (Sox2, Brachuyury), которая оказалась похожей на паттерн экспрессии маркеров эмбрионов на стадии E8.5.
В то же время, внезародышевые ткани синтетических эмбрионов отличались от естественных. Субкластерный анализ показал, что во внезародышевой энтодерме эмбрионов на 6-й день присутствовали клетки, которых нет у естественных эмбрионов («ETiX-only extraembryonic endoderm»).
Синтетические эмбрионы – это перспективные модели для исследования роли различных линий клеток и генов в развитии. Исследования показывают, что создание эмбрионов возможно из агрегации линий стволовых клеток выделенных из эмбриона, а также из наивных плюрипотентных стволовых клеток путем воздействия на их геном. Дальнейшая оптимизация условий культивирования и выращивания эмбрионов, платформ для агрегации позволит создать модели эмбрионов, более приближенные к естественным, без отклонений и нарушений в развитии.
Список литературы:
1. Ariff Bongso, Lee E.H. Stem Cells: From Bench to Bedside. 565 p.
2. Tarazi S. et al. Post-gastrulation synthetic embryos generated ex utero from mouse naive ESCs // Cell. 2022. Vol. 185, № 18. P. 3290-3306.e25.
3. Amadei G. et al. Synthetic embryos complete gastrulation to neurulation and organogenesis // Nature. Nature Publishing Group, 2022. P. 1–3.
Новость подготовила © Евгения Ерофеева
01.11.2022