 © Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
© Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
Человеческие плюрипотентные стволовые клетки (hPSC) могут пролиферировать в культуре in vitro неограниченно долго, что делает их привлекательным источником клеток для регенеративной терапии. Однако, ранее неоднократно было отмечено, что во время культивирования hPSC могут накапливать мутации, дающие селективные пролиферативные преимущества в культуре клеток. Так, например, в ряде работ было отмечено, что эмбриональные стволовые клетки человека (hESC) могут приобретать хромосомные перестройки, вызывающие увеличенную экспрессию BCL-XL, что дает мутантным клонам анти-апоптотические свойства [1,2].
В рассматриваемой работе, выполненной на базе Гарвардского университета, авторы решили основательно подойти к вопросу исследования приобретаемых мутаций в культурах hPSC для того, чтобы оценить их характер, степень и функциональные эффекты. Для этого они выполнили впечатляющий по своим масштабам эксперимент - проанализировали белок-кодирующие последовательности генома (т.н. экзомы) в 140 независимых линиях hESС (из 19 различных научных организаций), в том числе 26 линий, подготовленных для потенциального клинического использования. Все исследуемые линии клеток постулировались как «здоровые» контрольные линии клеток, полученных от здоровых доноров, без известных мутаций или хромосомных перестроек. В итоге проведенной работы авторы идентифицировали 263 мутации, для 28 вариантов из этого числа было предсказано грубое нарушение функций гена. Единственным геном, на который приходилось больше одной мутации (шесть) оказался ген TP53, кодирующий, наверное, самый известный и изученный опухолевый супрессор P53. Эти мутации находились в пяти различных несвязанных между собой линиях hESС. Оказалось, что найденные мутации уже описаны в литературе, являются доминантными и наиболее часто встречаются при раковых заболеваниях человека. При помощи цифрового ПЦР исследователи оценили долю клеток, содержащих данные мутации в культуре – оказалось, что доля лежит в широком диапазоне: 13-79%. Также было отмечено, что доля мутантных аллелей TP53 увеличивалась по мере культивирования клеток в стандартных условиях, что указывает на то, что изучаемые мутации обеспечивают носителям селективное преимущество. Так, например, для линии WA26 оказалось, что доля мутантных клеток повысилась с примерно 10% до 70% всего за 6 пассажей (с 13 по 19 пассажи) (Рис.1)
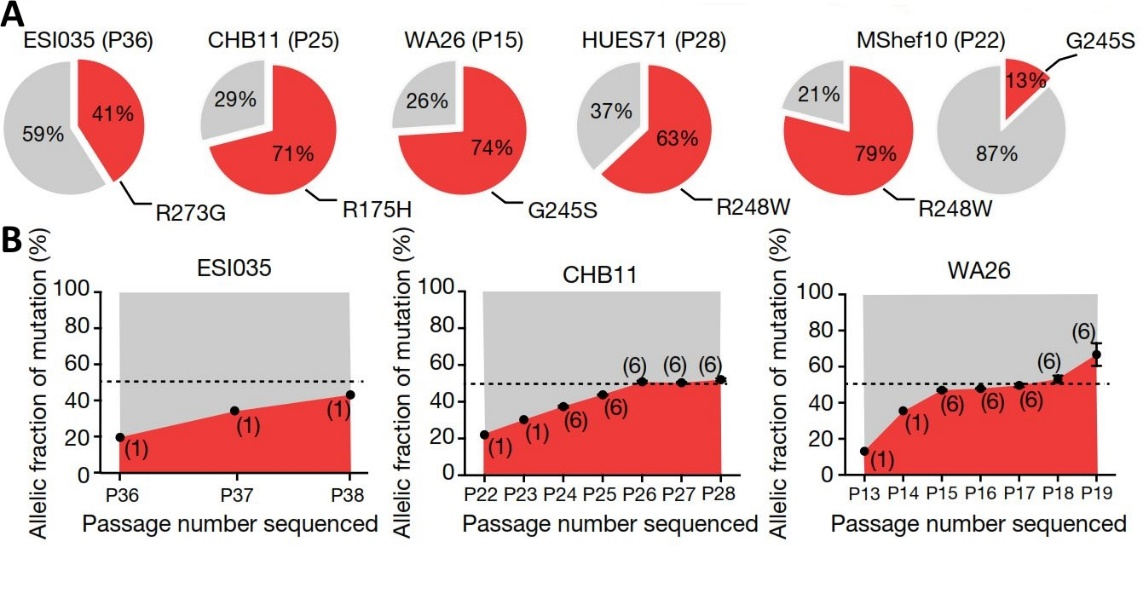 |
Рис.1.
А – Доля клеток с содержанием различных мутаций в гене TP53 в общей популяции клеток в линии (ES1035, CHB11, WA26, HUES71, MShef10 – названия линий hESС, в скобках указан номер пассажа, на котором проводился анализ; R273G, R175H, G245S, R248W – названия исследуемых
B – Увеличение доли мутантных клеток в культуре по мере их пассирования.
Далее авторы проанализировали довольно большое количество транскриптомов (полное секвенирование РНК-транскриптов) выложенных в открытом доступе, еще в 117 линий hPSC. Всего было найдено еще девять дополнительных мутаций TP53, все из которых должны были приводить к значимым изменениям в ДНК-связывающем домене белка P53.
Таким образом, экспериментальным путем на большой выборке исследуемого материала было показано, что появление и экспансия связанных с раком мутаций в клетках hPSС культивируемых in vitro, это естественный и необратимый процесс. Данные процессы могут остаться незамеченными во время рутинного культивирования, поэтому авторы призывают к тщательной проверке генетических характеристик hPSС и их дифференцированных производных, до того, как они будут применены в клинике. В целом же стоит отметить, что несмотря на все это, подавляюще большая доля (порядка 95%) линий hPSС не показали наличия значимых онкогенных мутаций, что позволяет надеяться на продолжение исследований по использованию плюрипотентных стволовых клеток в регенеративной медицине.
- Avery, S. et al. BCL-XL mediates the strong selective advantage of a 20q11.21 amplification commonly found in human embryonic stem cell cultures. Stem Cell Rep. 1, 379–386 (2013).
- Nguyen, H. T. et al. Gain of 20q11.21 in human embryonic stem cells improvescell survival by increased expression of Bcl-xL. Mol. Hum. Reprod. 20, 168–177(2014).
Новость подготовил © Дашинимаев Э.Б.
30.05.2017