
Область научных интересов: межклеточные и клеточно-матриксные взаимодействия, регенеративная медицина, бесклеточная терапия, опухолево- стромальные взаимодействия, опухолевое микроокружение.
По данным PubMed, обзор Dagar et al. (2023) – один из 160 обзоров, вышедших за последний год, который посвящен использованию потенциала CAR-T клеток в лечении солидного рака, и один из 580 обзоров, посвященных лечению всех видов рака этими клетками, показывая, что данная область изучается достаточно интенсивно.
Адаптивный перенос клеток (adoptive cell transfer, ACT) – это вид иммунотерапии, разработанный для лечения поздних стадий злокачественных новообразований, устойчивых к традиционным методам лечения. ACT включает выделение определенных клеток у пациента, их обогащение и модификацию ex vivo, экспансию в больших количествах и реинфузию пациенту для специфического нацеливания и уничтожения раковых клеток.
ACT среди множества методов иммунотерапии рака является уникальным подходом, поскольку в нем в качестве лекарства используются противоопухолевые иммунные клетки. Начиная с новаторских исследований с использованием опухоль- инфильтрирующих лимфоцитов (англ. tumor-infiltrating lymphocytes, TILs), генно- инженерная Т-клеточная терапия стала надежным подходом к рациональной генерации противоопухолевых Т-клеток против определенных целевых антигенов. В дополнение к использованию рецептора Т-клеток (T cell receptor, TCR), Т-клетки могут быть сконструированы с использованием химерного антигенного рецептора (chimeric antigen receptor, CAR), синтетического рецептора, который позволяет Т-клеткам распознавать и уничтожать клетки-мишени, экспрессирующие родственный лиганд, независимо от типа человеческих лейкоцитарных антигенов или антигенов тканевой совместимости. С момента своего первого открытия структура CAR претерпела значительные изменения, от первого поколения к пятому поколению, предлагая новые терапевтические альтернативы для больных раком. В попытках повысить активность, устойчивость, пролиферацию, безопасность и эффективность, в структуре CAR производили изменения за счет модификации эндодомена и количества используемых ко-стимулирующих молекул.
CAR-Т клеточная терапия использует Т-клетки, которые играют важную роль в управлении иммунным ответом для борьбы с раком, путем подбора лечения для каждого пациента. Это включает в себя сбор собственных Т-клеток пациента и их модификацию в лаборатории для создания на их поверхности CAR. Эти CAR предназначены для нацеливания и прикрепления к специфическим антигенам, обнаруженным на раковых клетках.
С 2017 года CAR-T терапия продемонстрировала глубокие и стойкие результаты у пациентов с лимфомой, лейкемией или множественной миеломой. Всего с октября 2017 года Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) США было одобрено 6 CAR-T препаратов с нацеливанием на CD19 или антиген созревания B-клеток (B-cell maturation antigen, BCMA) для лечения некоторых гематологических видов рака: Yescarta (axicabtagene ciloleucel), Kymriah (tisagenlecleucel), Tecartus (brexucabtagene autoleucel), Breyanzi (lisocabtagene maraleucel), Abecma (idecabtagene vicleucel), Carvykti (ciltacabtagene autoleucel). Однако после лечения CAR-T-клетками даже при значительном первоначальном ответе часто наблюдаются рецидивы и рефрактерные случаи.
Терапия CAR-T клетками имеет несколько ограничений: высокая стоимость и трудоемкость производства, синдром высвобождения цитокинов (cytokine release syndrome, CRS), синдром нейротоксичности, связанной с иммунными эффекторными клетками (immune effector cell-associated neurotoxicity syndrome, ICANS), внеопухолевая токсичность (“on-target/off-tumor” toxicity) и, в случае донорских CAR-T, реакция «трансплантат против хозяина» (graft versus host disease, GVHD).
Несмотря на успехи, достигнутые при лечении некоторых видов рака крови, до настоящего времени не было достигнуто аналогичного клинического успеха для большинства солидных опухолей. Низкая эффективность терапии CAR-T клетками при солидных опухолях обусловлена несколькими факторами, связанными как с качеством введенных CAR-T клеток, так и с иммуносупрессивным микроокружением опухоли (tumor microenvironment, ТМЕ) (рисунок 1): недостаточной экспансией и персистенцией in vivo, недостаточной доставкой введенных CAR-T клеток к очагу опухоли, недостаточной инфильтрацией опухоли CAR-T клетками, недостаточной эффекторной функцией введенных клеток, истощением Т клеток в иммуносупрессивном TME, отсутствием подходящих опухолеспецифических антигенов, а также внутренней гетерогенностью целевого антигена или потерей антигена раковыми клетками-мишеней.
TME играет решающую роль в прогрессировании рака, снижая эффективность CAR-Т клеток, за счет нескольких механизмов, таких как физические барьеры (плотная строма) и нарушение клеточного метаболизма. Избыточное накоплением внеклеточного матрикса (гиалуронана, коллагена) в ТМЕ и плохая васкуляризация опухоли способствуют повышению интерстициального давления и нарушению перфузии, что в свою очередь, приводит к гипоксии; растворимые продукты нарушенного клеточного метаболизма внутри опухоли, низкий уровень pH, ингибирующие поверхностные белки, такие как PD-L1, могут нарушать рекрутирование, проникновение, активацию и персистенцию цитотоксических лимфоцитов (CTLs)/CAR-T клеток в опухолевой ткани, одновременно способствуя рекрутированию клеток-иммуносупрессоров (myeloid-derived suppressor cells (MDSCs), tumor-associated macrophages (ТАМs) и regulatory Т-cells (Treg)), что позволяет опухолевым клеткам избежать иммунного обнаружения.
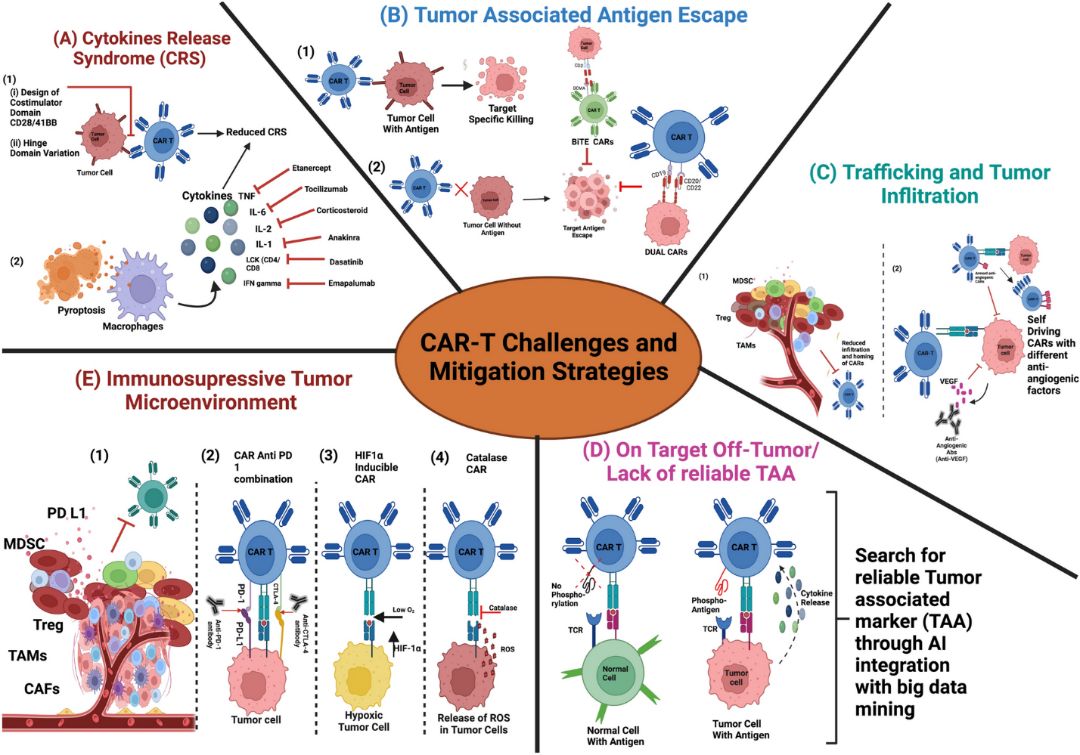
Рис. 1. Проблемы CAR-T-клеточной терапии и стратегии их решения. (А) Синдром высвобождения цитокинов; (B) Ускользание опухоль-ассоциированного антигена; (C) Доставка CAR-T клеток и инфильтрация ими опухоли; (D) Внеклеточная токсичность/Отсутствие надежных опухоль-ассоциированных антигенов; (E) Иммуносупрессивное TME. BiTE, bispecific T-cell engagers; HIF1α, hypoxia inducible factor 1 alpha; ROS, reactive oxygen species.
Помимо вышеперечисленных проблем с CAR-T клетками, FDA сообщило о возникновении вторичных злокачественных новообразованиях после иммунотерапии CAR-Т клетками (ссылка).
С тех пор, как 5 февраля 2021 года был одобрен четвертый препарат для CAR-T терапии, Breyanzi (направлен на CD19), FDA стало известно о риске Т-клеточных злокачественных новообразований с серьезными исходами, включая госпитализацию и смерть, после лечения генетически модифицированными аутологичными Т-клетками.
В ноябре 2023 года FDA начало расследование CAR-положительных лимфом. Сообщения о злокачественных новообразованиях Т-клеток были получены в результате постмаркетинговых сообщений о нежелательных явлениях и отчетов о клинических исследованиях, описывающих возникновение зрелых Т-клеточных злокачественных новообразований, включая CAR-положительные опухоли, после иммунотерапии CAR-Т клетками. Тем не менее представители агентства заявили, что польза от лечения CAR-T, одобренного для лечения лимфомы, лейкемии и множественной миеломы, перевешивает потенциальные опасности.
На брифинге от 8 января 2024 года Питер Маркс, доктор медицинских наук, директор Центра оценки и исследований биологических препаратов FDA, подчеркнул необходимость для производителей CAR-T контролировать участников клинических исследований и пациентов, получающих CAR-T, после одобрения исследования на протяжении всего периода применения, всю жизнь пациента, чтобы выявлять любые новые злокачественные новообразования и тестировать ген CAR, когда они возникают.
В письмах производителям препаратов CAR-T об изменении маркировки безопасности от 19 января 2024 года FDA заявило, что в информацию о назначении должны быть включены предупреждения в рамке, самый сильный тип предупреждений.
25 января 2024 года FDA после анализа отчетов, подчеркивающих риск злокачественных новообразований Т-клеток с некоторыми случаями летального исхода, заказало новые предупреждения/«black box» для терапии CAR-T клетками. Новое предупреждение распространяется на все методы иммунотерапии с использованием генетически модифицированных аутологичных Т-клеток, направленных на BCMA и CD19. Предупреждения на маркировке для терапии CAR-T уже содержат предостережения о риске вторичных злокачественных новообразований.
Таким образом, многочисленные проблемы пока ограничивают эффективность CAR-Т клеточной терапии опухолевых заболеваний.
Новость подготовила
© А.В. Кузнецова
01.04.2024