 © Риппа Александра Леонидовна, кандидат биологических наук, научный сотрудник.
© Риппа Александра Леонидовна, кандидат биологических наук, научный сотрудник.Область научных интересов: биология кожи, ранозаживление, клеточная пластичность, механизмы клеточной пролиферации и дифференцировки.
Обретение формы клеточной тканью можно описать как производное коллективных и индивидуальных механических свойств клеток и способов, благодаря которым они интегрируются в окружающую ткань. В свою очередь, архитектура ткани и ее динамические изменения управляют поведением клеток. Так, например, при увеличении напряжения (сжатия) в коже фибробласты трансформируются в миофибробласты, участвующие в формировании рубцовой ткани (Hsu et al., 2018; Harn et al., 2019). Кожа представляет собой динамичный, самообновляющийся барьерный орган, подвергающийся масштабным нагрузкам. Примечательно, что плотные контакты образуются только в третьем зернистом слое эпидермиса, несмотря на экспрессию необходимых компонентов во всех слоях. Эти особенности подчеркивают уникальные, зависящие от слоя черты распределения напряжения в эпидермисе (Biggs et al., 2020). В последнее время появляется все больше данных о том, как изменение механических свойств ткани влияет на поведение клеток. Изучение связи механотрансдукции с механизмами клеточной пролиферации, дифференцировки и трансформации важно для понимания развития морфогенетических событий, патологических изменений, поиска способов стимуляции регенерации тканей.
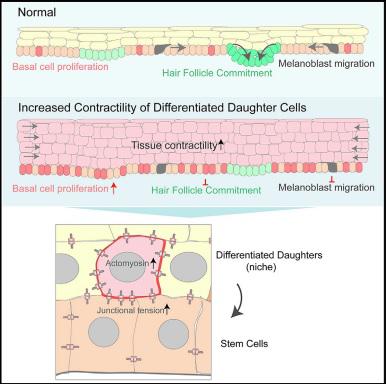
В недавнем исследовании Ning и соавторы, используя две отдельные линии мышей K10-Spastin и K10-Arhgef11 обнаружили, что увеличение сократимости дифференцированных клеток приводит к гиперпролиферации базальных клеток эпидермиса и предотвращает их коммитирование в направлении клеток волосяных фолликулов в эмбриогенезе. Повышенная сократимость дифференцированных клеток также нарушала миграцию базальных прогениторов во время морфогенеза волосяных плакод и уменьшала миграцию меланобластов.
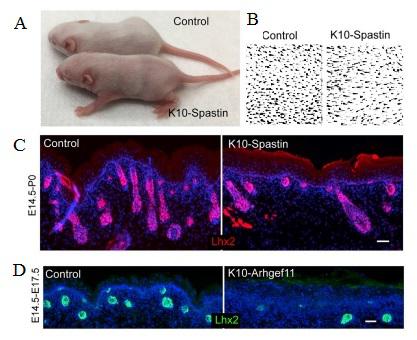
У полученной авторами линии мышей «кератин [K] 10-rtTA; TRE-HA-Spastin» (далее K10-Spastin) экспрессия активной форма белка спастина в дифференцированных кератиноцитах супрабазальных слоев эпидермиса приводила к деполимеризации микротрубочек. Разобщение микротрубочек в этих клетках приводило к гиперпролиферации базальных стволовых клеток кожи, как во время развития, так и во взрослом возрасте (Рисунки 1B – 1D). Обнаружились значительные изменения в генах, связанных с сократимостью актомиозина, около 50% генов, составляющих конктрактом, дифференциально экспрессировались в супрабазальных клетках при нарушении структуры микротрубочек, включая миозин IIC и факторы ROCK2, RhoC и ARHGEF2. Разрушение микротрубочек в дифференцированных клетках вызывало резкое увеличение кортикального F-актина и миозина II (Рисунки 1E и 1F). Молекулы немышечного миозина II собираются в биполярные филаменты и связываются с F-актином, генерируя сократительные усилия. Эти данные показывают, что деполимеризация микротрубочек может увеличивать сократимость кортикального актомиозина в супрабазальных дифференцированных клетках эпидермиса. Авторы применили оригинальный способ наглядно продемонстрировать повышенную сократимость кожи мутантов – они культивировали экспланты кожи в течение суток, после чего площадь экспланта мутантной кожи значительно сократилась вследствие повышенной контракции (Рисунки 1G). Поскольку кортикальный актомиозин был увеличен в супрабазальных клетках с разрушенными микротрубочками, авторы проверили, влияет ли его повышенное количество на адгезионные контакты in vivo. Было продемонстрировано, что повышенная сократимость актомиозина приводит не только к повышенному натяжению межклеточных контактов, но и к стабилизации кортикальных комплексов Е-кадгерина.
Чтобы проверить прямое влияние сократимости супрабазальных клеток на регуляцию базальных стволовых клеток, авторы получили линию мышей, «кератин K10-rtTA; TRE-Arhgef11CA» (далее K10-Arhgef11), которая обеспечивает индуцируемую доксициклином экспрессию Arhgef11CA в супрабазальных клетках. Экспрессия Arhgef11CA вызывает увеличение сократимости актомиозина без нарушения микротрубочек. Экспрессия Arhgef11CA вызывала схожие эффекты: увеличение кортикального F-актина и напряжения в межклеточных контактах дифференцированных кератиноцитов, стабилизацию кортикальных комплексов Е-кадгерина, контракцию кожных эксплантатов, увеличение пролиферации базальных стволовых клеток эпидермиса в эмбриональной и зрелой коже. Фенотип этих мышей был такой же, как у мышей K10-Spastin с преждевременным приобретением эпидермисом барьерьерных свойств (корнификацией) и нарушенной морфологией корнеоцитов. В целом эти данные демонстрируют, что увеличение сократимости дифференцированных клеток достаточно для индукции пролиферации стволовых клеток. Исключив экспрессию Arhgef11CA в гранулярных кератиноцитах, авторы показали, что для стимуляции пролиферации базальных клеток необходим прямой межклеточный контакт между контрактильным дифференцированным шиповатым кератиноцитом и базальным прогенитором.
Во время развития кожи в базальном слое происходит определение судьбы стволовых клеток эпидермиса. Они либо дифференциируются и двигаются вверх в многослойный межфолликулярный эпидермис или инвагинируют и мигрируют в дерму, образуя волосяные фолликулы. В обеих моделях мышей K10-Spastin и K10-Arhgef11 наблюдали явное снижение формирования волосяных фолликулов (рис. 2). Авторы индуцировали экспрессию K10-Arhgef11 в разные окна развития волосяных фолликулов. Ранняя индукция имела бОльший эффект, и волосяных фолликулов в коже развивалось меньше. Это позволяет предположить, что сократимость, вероятно, была важна в ранний период морфогенеза волосяного фолликула и существенно не влияла на волосяные фолликулы после того, как они прошли начальную стадию развития. Дефекты волосяных фолликулов, наблюдаемые у эмбрионов K10-Spastin, были в значительной степени нивелированы применением ингибиторов сократимости.
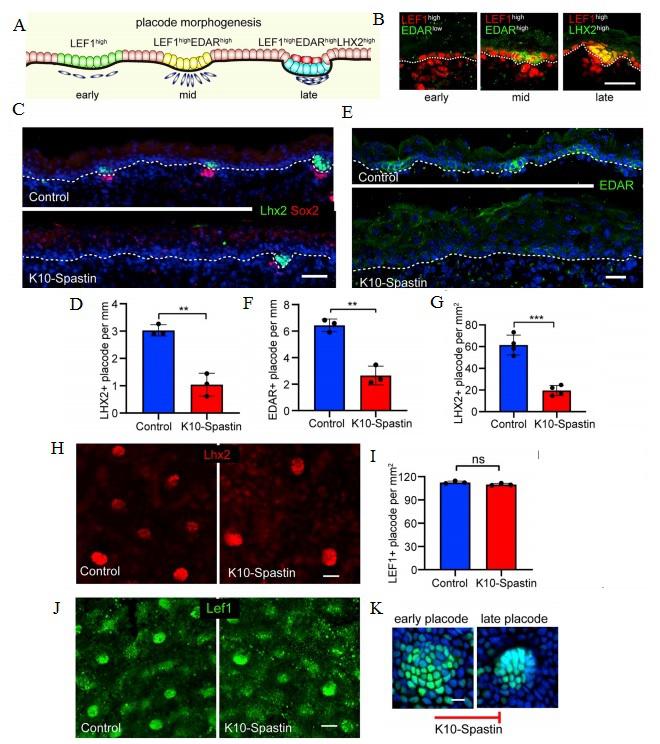
Авторы определили экспрессию Lef1, Edar и Lhx2 в качестве маркеров ранней, средней и поздней стадии плакоды волосяных фолликулов (рис. 3A, 3B). Соответственно, количество поздних плакод Lhx2+ (рисунки 3C, 3D, 3G, 3H) и плакод на средней стадии развития EDAR + было уменьшено в эмбриональной коже K10-Spastin по сравнению с контролем (рисунки 3E, 3F). Затем исследовали экспрессию Lef1, самого раннего маркера плакод волосяных фолликулов. Выяснилось, что общее количество пятен Lef1 в эпидермисе в контроле и у мутанта K10-Spastin было сходным (рисунок 3I), демонстрируя, что первоначальная спецификация волосяного фолликула не пострадала. Однако в эпидермисе К10-Spastin плакоды в основном были ранними и диффузными (рисунок 3J). Ранние плакоды Lef1 + содержали одинаковое количество клеток в коже контроля и мутанта. Таким образом, последующие дефекты не были результатом изменения количества клеток плакоды. Следовательно, контрактильность супрабазальных клеток регулирует судьбу волосяных фолликулов, а не их спецификацию (рис. 3K). Динамика клеток плакод показала, что в норме ранние плакоды последовательно изменяли морфологию и со временем становились меньшего диаметра. Этого не происходило в мутантной коже. В контрольной коже прогрессировали 80% плакод, тогда как менее 20% прогрессировали в мутантной. Треки единичных клеток внутри плакоды были короче у мутантов по сравнению с тканью дикого типа. Сократимость актомиозина в дифференцированных супрабазальных клетках контролирует судьбу прогениторных клеток, регулируя миграцию этих клеток во время стадии плакоды морфогенеза волосяных фолликулов.
Для клеточной подвижности требуется ремоделирование контактов. В эпидермисе мышей K10-Spastin наблюдается снижение миграции клеток, в том числе меланобластов. Вероятно, это является результатом усиления адгезионных контактов, вызванных повышенной сократимостью.
Понимание того, как судьба и поведение стволовых клеток управляются сигналами локального микроокружения, называемого нишей, имеет фундаментальную значимость. Дифференцированные клетки механически соединены с базальными прогениторами. Избыточное напряжение супрабазальных дифференцированных клеток в коже мутантов нарушает баланс между самообновлением и дифференцировкой самих базальных клеток, по-видимому блокируя возможность дочерней клетки уйти в дифференцировку при перпендикулярной ориентации веретена деления материнской базальной клетки. Координация клеточной адгезии и механики оказывается критической для правильного ухода дифференцирующихся клеток из базального слоя.
Литература
- Hsu CK., Lin H.H., Harn H.I., Hughes M.W., Tang M.J., Yang C.C. Mechanical forces in skin disorders.J. Dermatol. Sci. 2018; 90:232–240. doi: 10.1016/j.jdermsci.2018.03.004.
- Harn H.I., Ogawa R., Hsu C.K., Hughes M.W., Tang M.J., Chuong C.M. The tension biology of wound healing. Exp. Dermatol. 2019; 28:464–471. doi: 10.1111/exd.13460.
- Biggs L.C, Kim C.S, Miroshnikova Y., Wickstrom S.A. Mechanical forces in the skin: roles in tissue architecture, stability, and function. J Invest Dermatol. 2020; 140(2):284-290. doi: 10.1016/j.jid.2019.06.137.
Новость подготовила © Риппа А.Л.
31.03.2021